各位常年做生信的小伙伴们可能对泛癌分析已经无比熟练了,小云这两天在逛pubmed的时候,突然看到一篇高达37.3分的文章,迫不及待地想分享给小伙伴们。各位小伙伴们都知道,泛癌分析文章很多,但大多数文章的分值一般在10分以下,那这篇文章凭什么拿到高分的呢?
小云细细阅读了这篇文章,发现其拿到高分绝对是名副其实!其有以下几个优点:
- 本研究的研究对象是肿瘤相关成纤维细胞(CAF),CAF细胞是近几年国自然的新宠儿,并且近几年其SCI发文量逐年上升,本文紧跟热点话题,妥妥的吸人眼球!
- 空间转录组与单细胞数据相结合。空间转录组可以帮助我们理解细胞之间的空间关系以及基因在整个生物体内的定位,而对某些具体的细胞类型可能了解不够。然而,单细胞测序可以揭示不同细胞类型、状态以及功能的差异,可以更好地理解细胞的多样性和复杂性。所以二者强强联合,也使得文章创新性瞬间提高!
- 自测数据与公共数据相结合,共同揭示癌症相关成纤维细胞和肿瘤微环境之间的串扰,使文章的质量瞬间提升,再也不怕审稿人以公共数据评估不准确而拒稿啦!
- 本研究的研究思路新颖且数据量大。本文首先分析CAFs不同的功能亚群,并研究其空间分布特征。又在空间背景下进行的细胞-细胞相互作用分析,强调基质CAFs (mCAFs)在肿瘤血管生成和炎症性CAFs (iCAFs)在形成免疫抑制微环境中的关键作用。一套操作下来,深入研究了癌症相关成纤维细胞与肿瘤微环境之间的相互影响,让人感叹思路亮眼,逻辑清晰,妥妥的高分文章!
这不就是泛癌高分SCI的优秀模板吗?这种空间转录组+单细胞测序的套路在近两年是真香啊!想要发表高分SCI的小伙伴们还不赶快借鉴一下本文的研究思路,换个“细胞”赶紧上车! (ps:不知道怎么创新的小伙伴可以来找小云!这里有新鲜出炉的生信热点方向,还有一大波的可复现的创新思路,感兴趣的直接扫码联系我吧!)。


- 题目: 泛癌空间单细胞分析揭示了癌症相关成纤维细胞与肿瘤微环境之间的串扰
- 杂志:Molecular Cancer
- 影响因子:IF=37.3
- 发表时间:2023年10月
研究背景
癌症相关成纤维细胞(CAFs)是一种异质性细胞群,其在协调TME重组中起着至关重要的作用。然而,目前包括免疫治疗和化疗在内的大多数治疗方法在很大程度上忽视了CAFs的关键作用。因此,本研究旨在通过综合的数据资源为TME中针对CAFs的治疗策略的开发提供了新的见解和指导。
数据来源
| 数据集/队列 | 数据库 | 数据类型 | 详细信息 |
| GSE176078 | GEO | scRNA-seq数据 | 26例乳腺癌样本 |
| GSE166555 | GEO | scRNA-seq数据 | 16例结直肠癌患者的正常及邻近肿瘤样本 |
| GSE149614 | GEO | scRNA-seq数据 | 21例肝细胞癌样本 |
| GSE184880 | GEO | scRNA-seq数据 | 12例卵巢癌样本 |
| GSE203612 | GEO | scRNA-seq数据 | 泛癌的空间转录组学数据 |
| GSE207422 | GEO | scRNA-seq数据 | 39例 NSCLC数据 |
| GSE215120 | GEO | scRNA-seq数据 | 11例黑色素瘤样本 |
| GSE181919 | GEO | scRNA-seq数据 | 37例头颈癌样本 |
| 接受pembrolizumab治疗的BRCA患者的scRNA-seq数据 | VIB – KU LEUVEN CENTER FOR CANCER BIOLOGY | scRNA-seq数据 | 接受pembrolizumab治疗的BRCA患者的scRNA-seq数据 |
| GSE176078 | GEO | ST数据 | 26例乳腺癌样本 |
| GSE203612 | GEO | ST数据 | 泛癌的空间转录组学数据 |
| GSE91061 | GEO | RNA-seq数据 | 接受免疫治疗的黑色素瘤患者 |
| Gide队列 | TIDE | RNA-seq数据 | 接受免疫治疗的黑色素瘤患者 |
| Nathanson队列 | TIDE | RNA-seq数据 | 接受免疫治疗的黑色素瘤患者 |
| 22个组织切片整合的ST数据及其相应的scRNA-seq数据 | Synapse | ST数据及其相应的scRNA-seq数据 | 22个组织切片整合的ST数据及其相应的scRNA-seq数据 |
| PRAD | 在线网站(http://www.pradcellatlas.com/) | scRNA-seq数据 | PRAD的scRNA-seq数据 |
| CRC的ST数据 | 在线网站(http://www.cancerdiversity.asia/scCRLM/) | ST数据 | CRC的ST数据 |
| LIHC1、LIHC2、LIHC3和LIHC4的ST数据 | 在线网站(http://lifeome.net/supp/livercancer-st/data.htm) | ST数据 | LIHC1、LIHC2、LIHC3和LIHC4的ST数据 |
| OVCA_10x的ST数据 | 10xgenomics | ST数据 | OVCA_10x的ST数据 |
| PRAD1的ST数据 | 10xgenomics | ST数据 | PRAD1的ST数据 |
| PRAD2的ST数据 | 10xgenomics | ST数据 | PRAD2的ST数据 |
研究思路
基于六种常见癌症类型的空间和单细胞转录组学数据,分析CAFs的功能亚群,并描述它们的空间分布特征。在空间范围内进行细胞与细胞相互作用分析,深入分析基质CAFs(mCAFs)在肿瘤血管生成中的关键作用,以及炎性CAFs(iCAFs)在形成免疫抑制微环境中的关键作用。在接受抗PD-1免疫疗法的乳腺癌患者中,分析iCAFs在促进癌细胞增殖、促进上皮间质转化(EMT)以及建立免疫抑制微环境方面的作用。
主要结果
为了在泛癌中建立空间单细胞景观,本研究从56例诊断为6种常见癌症类型之一的患者的69个样本中获取了scRNA-seq数据,以及22例患者的22个组织切片的ST数据(图1a和b)。其中,10个组织切片的ST数据具有来自同一患者的相应的scRNA-seq数据 (图1c)。本研究收集的数据包括六种类型的癌症:乳腺癌(BRCA)、结直肠癌(CRC)、肝癌(LIHC)、卵巢癌(OVCA)、前列腺腺癌(PRAD)和子宫内膜癌(UCEC)(图1a)。以CRC为例,采用基于图聚类的方法,根据不同细胞类型的典型标记物识别出7个主要聚类,包括上皮细胞、成纤维细胞、内皮细胞、T&NK细胞、B细胞、髓样细胞和肥大细胞(图1e-f)。最后,本研究获得一个包含744289个细胞的泛癌空间单细胞转录组图谱(图1d和g)。
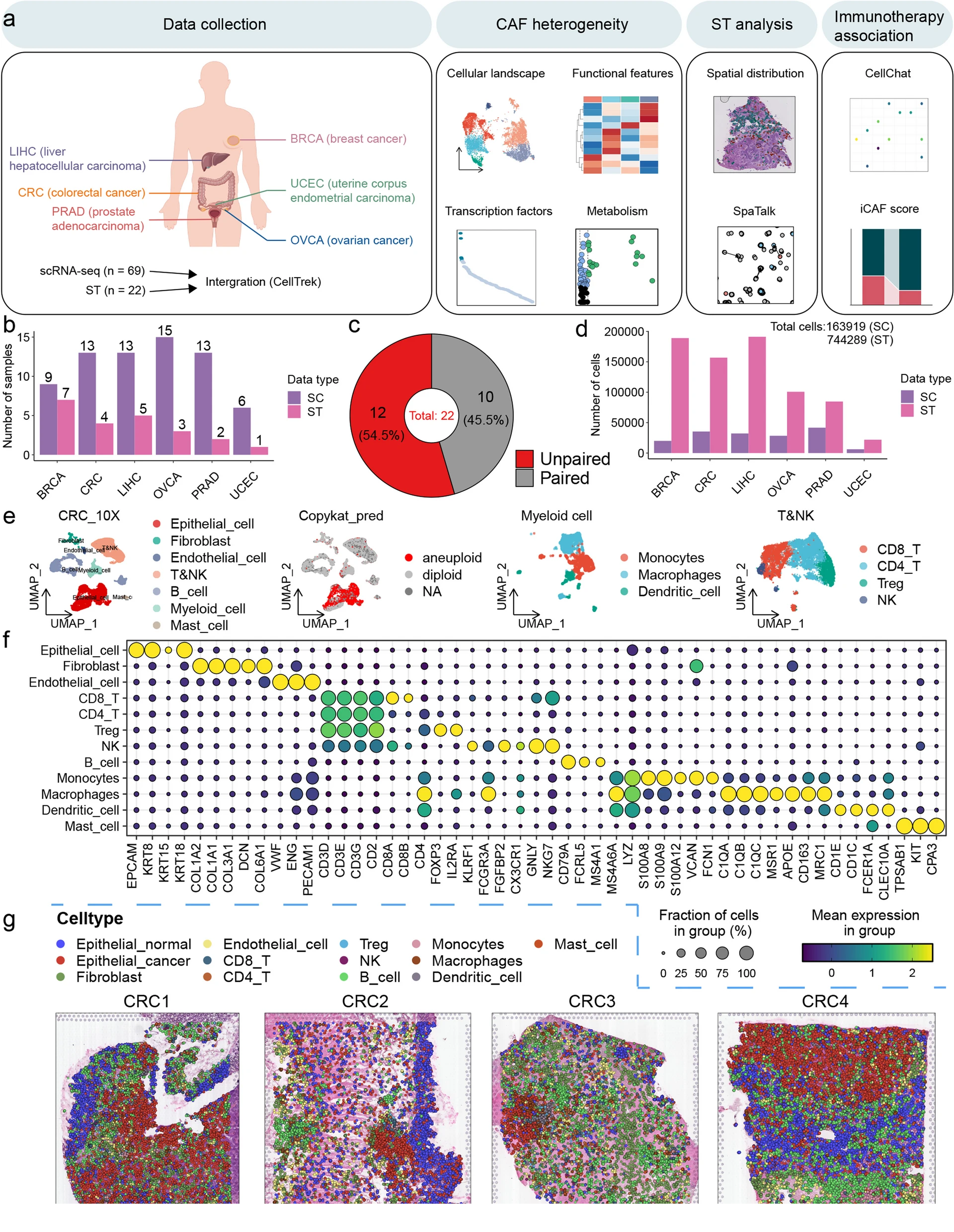 图1 泛癌空间单细胞转录组图谱的构建
图1 泛癌空间单细胞转录组图谱的构建
2. 泛癌CAF异质性
接下来,本研究分析了6种癌症类型的scRNA-seq数据集中成纤维细胞的异质性(图2a)。成纤维细胞簇的重新聚类鉴定出四种CAF亚型,以及周细胞和平滑肌细胞(图2a)。CFD +成纤维细胞显示高表达趋化因子(图2b)。标记基因的GO富集分析显示,它们与机械刺激、活性氧、上皮细胞增殖、免疫系统和细胞迁移的反应有关(图2c)。POSTN +成纤维细胞显示出ECM重塑基因高表达(图2b和c)。接下来,使用AUCell算法进一步研究了CAFs的异质性(图2d)。iCAFs在免疫相关功能方面表现出最高的活性,包括补体激活、趋化因子产生和炎症反应(图2d)。此外,血管生成、伤口愈合、ECM组织调节和胶原生物合成过程等都在mCAFs中富集(图2d)。尽管在6种癌症类型中,iCAFs和mCAFs是主要的CAFs细胞类型,但不同亚型的CAFs仍然表现出明显的癌症偏好(图2e和f)。并且与炎症相关的调节蛋白CDX2和与ECM重塑相关的调节蛋白TCF12分别在iCAFs和mCAFs中富集(图2g)。正如预期的那样,糖酵解和丙酮酸在meCAFs的顶层代谢途径中富集(图2h)。通过Slingshot分析,提出了从周细胞到iCAFs的潜在过渡途径(图2i)。GeneSwitches分析确定了从周细胞到iCAFs的途径中激活的多个生物过程,包括伤口愈合、细胞粘附调节、ECM、血管生成、胶原纤维组织、上皮间质转化和炎症反应(图2j)。
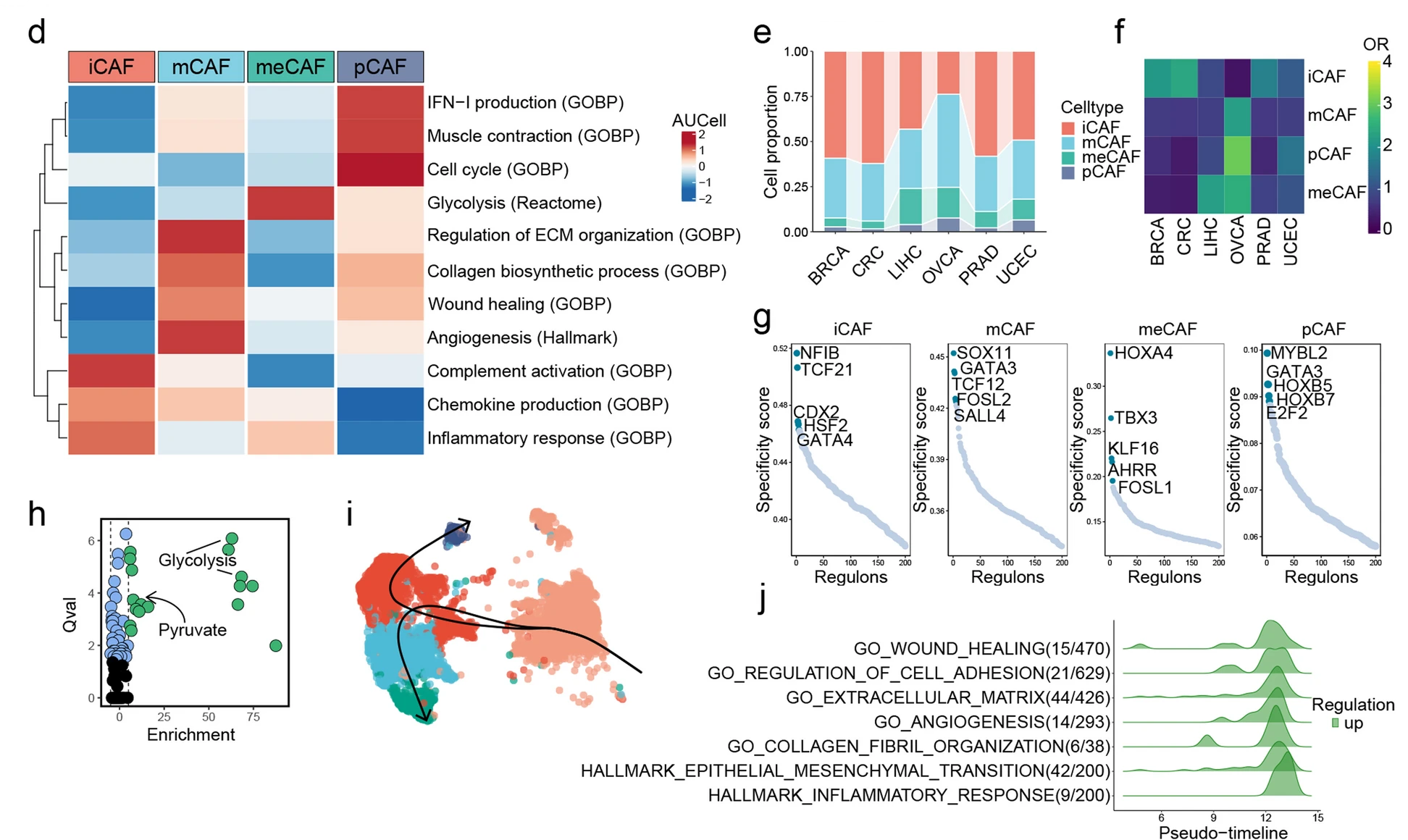
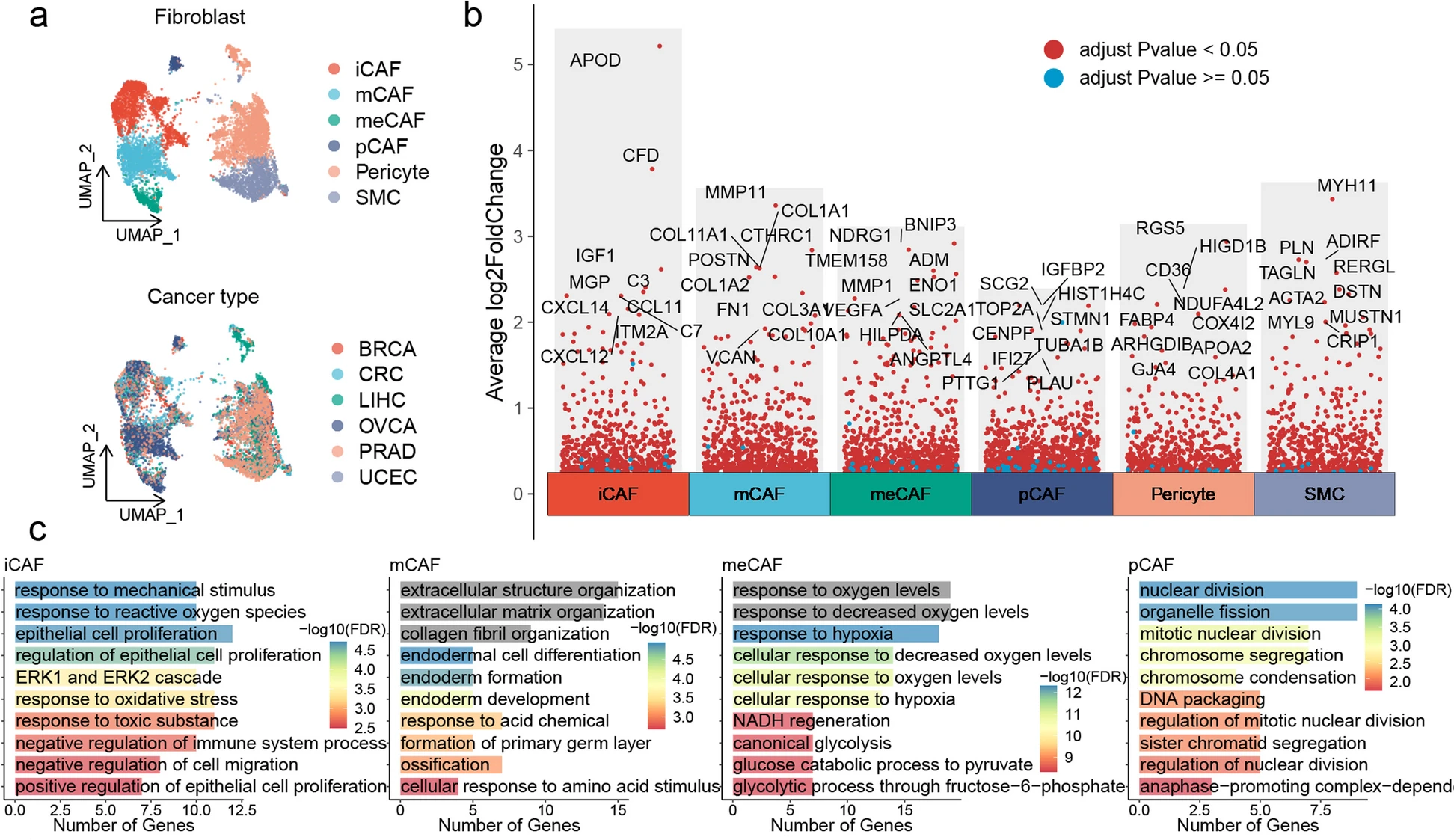
图2 泛癌CAF异质性
为了确定CAFs的空间分布特征,本研究观察到iCAFs和mCAFs的高密度区域之间存在空间排他现象(图3a -d),这表明CAFs的激活状态与其在TME中的位置有关。本研究计算了每个组织切片中所有细胞与成纤维细胞亚群之间的空间k距离,并使用RRA算法对它们进行整合,以获得所有细胞的综合排名。经分析,四种CAFs亚型之间的空间k距离最小,而免疫细胞亚型的排序没有显著差异(图3e- 1)。在每一种CAF亚型周围都有其他类型的CAF亚型的富集。值得注意的是,所有四种CAF亚型周围上皮细胞的比例都下降,这意味着这些亚型位于离上皮区域更远的地方(图3m)。总之,这些结果表明CAF在空间分布上存在明显异质性。
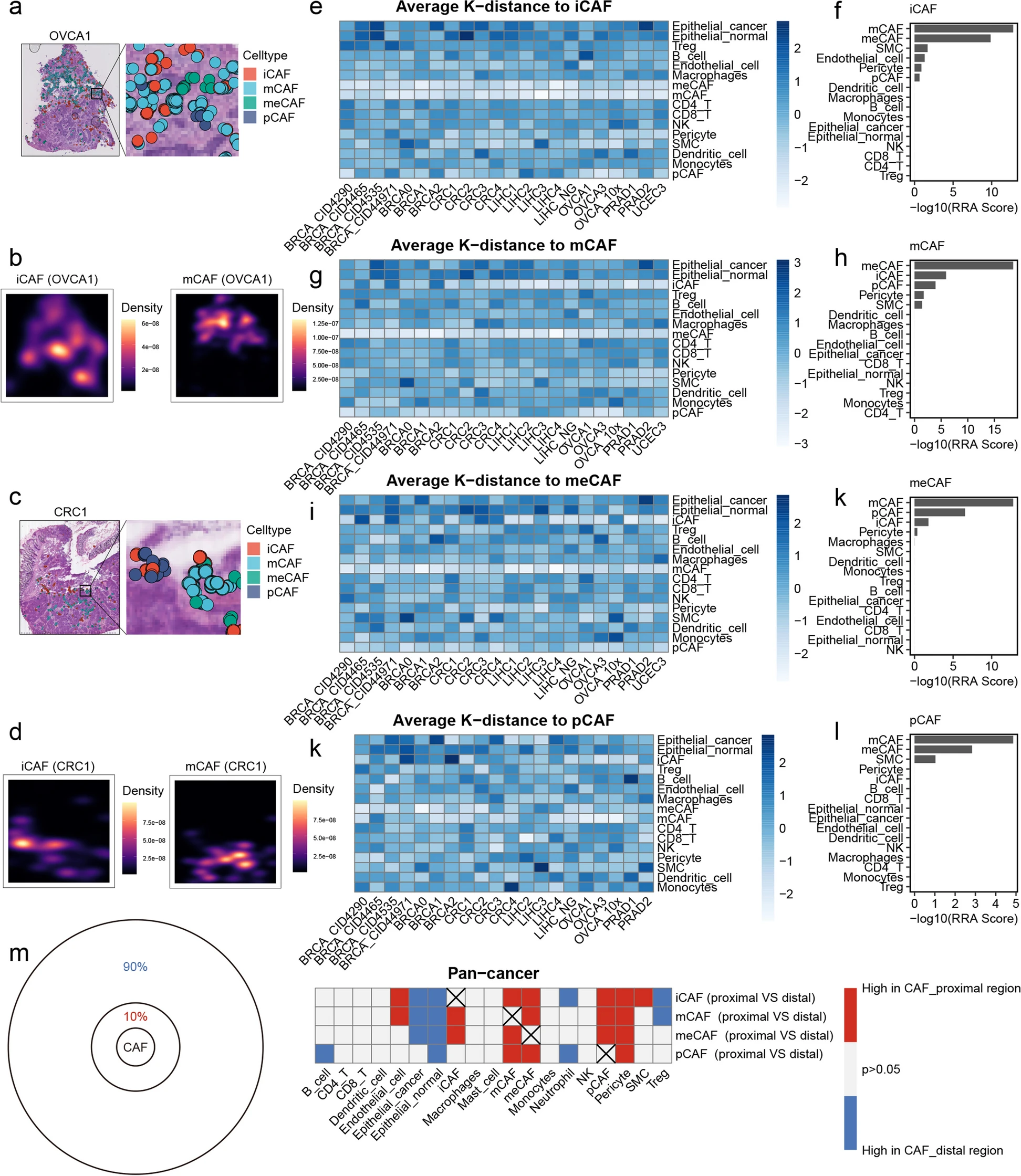
图3 CAFs的空间分布特征
鉴于mCAFs的高血管生成活性,本研究使用Spatalk来探索mCAFs与内皮细胞在空间背景下的相互作用。结果发现,在mCAFs中鉴定的配体被发现在各种内皮细胞功能中发挥重要作用,包括迁移、增殖、凋亡、趋化、分化和发育(图4a)。本研究进一步揭示了一系列与血管生成相关的配体-受体相互作用(LRIs) (图4d)。此外,从iCAFs到巨噬细胞的配体被发现显著地丰富了巨噬细胞的各种功能,包括分化、细胞因子产生、趋化性、迁移和激活(图4b)。考虑到M2巨噬细胞极化与肿瘤进展密切相关,本研究鉴定了一系列参与这一过程的LRIs (图4e)。CD8 + T细胞在抗肿瘤免疫中发挥关键作用,研究发现结合CD8 + T细胞的iCAFs配体富含各种T细胞相关功能,包括迁移、激活、增殖、趋化、分化、共刺激、凋亡过程、稳态、细胞因子产生、T细胞极性的建立、T细胞介导的免疫和细胞毒性(图4c)。值得注意的是,iCAFs可能通过LGALS1与CD8 + T细胞PTPRC受体相互作用,从而诱导CD8 + T细胞凋亡并损害其抗肿瘤功能(图4f)。本研究随后的分析集中LGALS1-PTPRC的相互作用,在各种肿瘤的ST组织切片中观察到这种相互作用(图4g)。在BRCA和LIHC的组织微阵列上进行的免疫荧光实验也揭示了大量的例子,其中CD阳性细胞和CD8阳性细胞表现出空间接近性(图4h)。
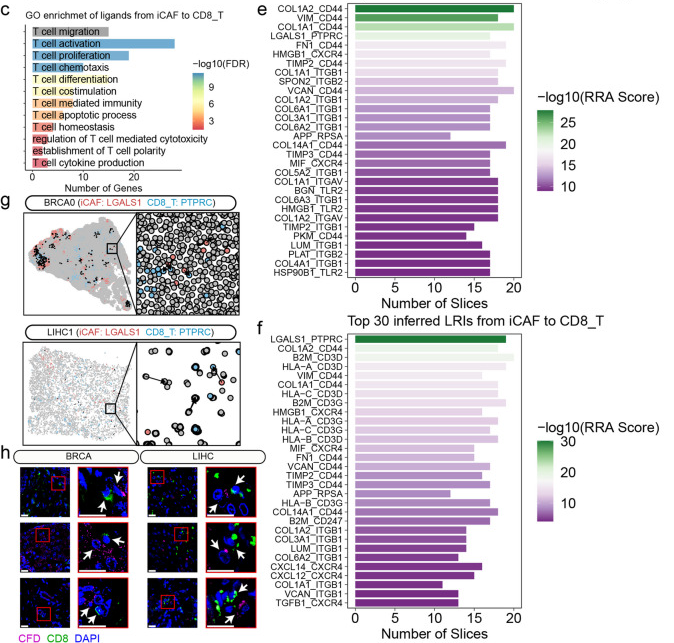
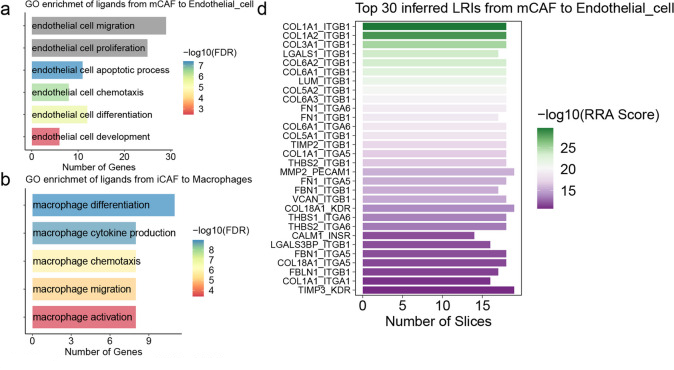
图4 CAFs通过旁分泌信号对TME的影响
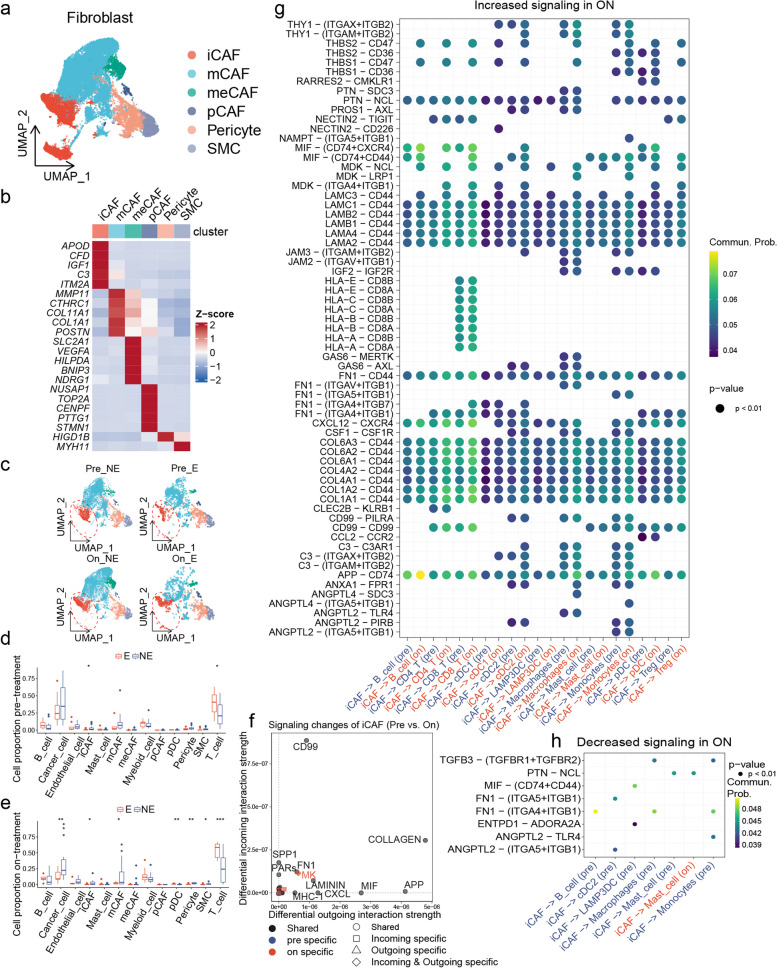
为了研究抗pd1治疗对iCAFs的影响,本研究对成纤维细胞进行聚类后,获得了与泛癌一致的CAF亚型分型结果(图5a和b)。在治疗期间,与未进行克隆扩张的患者相比,克隆扩张患者的癌细胞比例较低,这可能是因为具有细胞毒性活性的T细胞数量增加。此外,无论是治疗前还是治疗中,接受克隆扩张的患者中iCAFs的比例始终较低(图5c-e)。与预处理相比,iCAFs在治疗期间抑制CD8+ T细胞的激活、增殖和迁移 (图5f和g)。尽管iCAFs在治疗期间下调TGFB3,它们仍可能通过过表CSF-1促进单核细胞存活并向肿瘤相关巨噬细胞分化 (图5g和h)。总之,抗PD1治疗增强iCAFs促进免疫抑制微环境形成的能力。
考虑到TME中iCAFs与免疫细胞之间复杂的相互作用,本研究发现在所有队列中,iCAF评分高的患者表现出较长的总生存期(OS)和无进展生存期(PFS) (图6 a)。接下来,根据中位数将黑色素瘤患者分为高和低iCAF评分组,并比较两组之间ICB应答者的百分比。结果显示,iCAF评分高的患者对抗pd -1治疗的应答率更高(图6b)和抗ctla -4治疗(图6 c)。接下来,本研究分析了黑色素瘤患者的免疫景观,发现了高iCAF评分黑色素瘤患者中免疫检查点基因的表达更高,CNV扩增的频率更高(图6d)。由ESTIMATE算法计算的免疫评分和先前报道的免疫反应评分,也发现iCAF评分高的患者免疫反应评分更高(图6e)。这些数据表明,高iCAF评分患者在肿瘤免疫治疗中的获益可能依赖于免疫细胞浸润增加和免疫调节剂的相互作用。
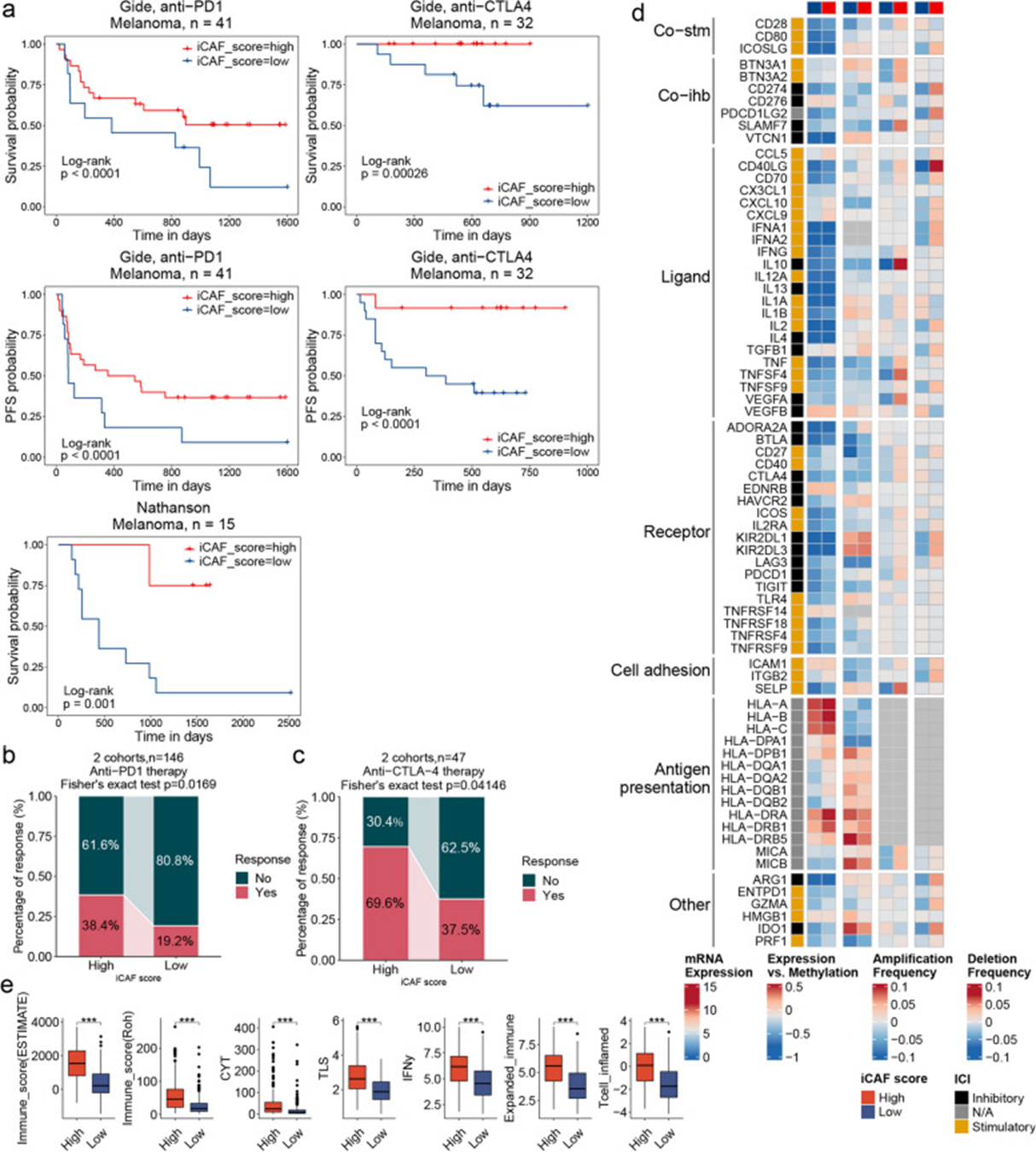
图6 iCAF评分与免疫治疗反应相关
文章小结
这篇文章可谓是紧跟当前研究潮流,选择了成纤维细胞这个热点话题,直接吸人眼球!同时又使用了空间转录组学和单细胞测序这两种当红的研究方法,创新性再次提升。对泛癌空间和单细胞数据的综合分析揭示了CAFs的异质性,揭示了它们的空间分布模式和与TME复杂的细胞通讯。本研究不仅增强了对CAF生物学特性的理解,而且为针对CAF的靶向治疗方法的开发提供了重要的见解。看到别的团队蹭蹭蹭地发文,你是不是也迫不及待准备大展身手啦?想在泛癌方向做点新东西的小伙伴,不要错过这个好思路,想复现的小伙伴们快快扫码联系小云吧!

小云公众号持续为大家带来最新生信思路,更多创新分析思路请点击链接。需要复现或定制分析思路的朋友欢迎call小云,风里雨里小云公众号等你!
往期推荐
1. 1个多月接收,24分+孟德尔随机化!双疾病分析这么做,0实验发高分就是如此简单!
2. 双硫死亡与铁死亡碰撞,机器学习与单细胞分析联袂,王炸组合拿下7分+!
3. 华西医院李响团队送你个10分+创新思路:生信和病理分析联姻,携手搞定皮质激素-免疫串扰难题!
4. OMG!用别人发表过的模型还能再发8分+纯生信?选好切入点,分析超简单,4图搞定1区top SCI
5. 0实验11分+影像组学复现新思路?看齐鲁医院李涛团队用机器学习构建放射组学模型!临床人快冲~