
各位小伙伴大家好!不知道大家有没有实验室经费不够、没有条件做实验这样的困扰呢?小云今天给大家分享一篇高质量文章,题目是:“Mucosal host-microbe interactions associate with clinical phenotypes in inflammatory bowel disease”。这个文章是通过生信分析来探索肠道微生物和炎症之间的相互关系的,绝对值得一读!我们来一起学习这篇文章的思路吧!相信也将是你拿下SCI的第一步!快搬小凳子来听讲吧!
这篇文章主要采用广义线性模型来评估粘膜宿主与微生物之间相互作用与炎症性肠病的临床表型之间的关系。通过RNA-seq和16S rRNA-seq技术对697份新鲜冷冻肠道活检样本进行了鉴定,使用R软件包(xgboost)区分IBD亚型,确定了与炎症相关的多个基因分类模块并建立了预测模型,说明不同患者根据病情需要针对性治疗。最后R软件包(ggview)可视化基因与微生物群网络互作分析,R软件包(Xcell)对肠道特定的细胞类型进行富集分析。除了样本的提取,整个文章使用了这么多生信相关的软件,这是正宗的干货分享啊!(ps:小云每日在线,努力宣传,您负责做决定,我负责让您满意!另外,小云这里还提供服务器租赁服务,需要的小伙伴赶紧联系小云吧~)


- 题目:粘膜宿主-微生物相互作用与炎症性肠病的临床表型相关
- 杂志:Nature Communications
- 影响因子:IF=16.6
- 发表时间:2024.2
研究背景
哺乳动物的肠道被数以万亿计的微生物定殖,这些微生物与宿主以共生关系共同进化。肠道上皮表面附近存在的大量共生菌给宿主带来了巨大挑战,因为它必须避免激活对微生物的有害炎症反应,同时保持其对入侵病原体进行强有力的免疫反应的能力。炎症性肠病(IBD)是是一种慢性炎症性肠道疾病的统称,主要包括克罗恩病(CD)和溃疡性结肠炎(UC)。这些疾病会导致肠道内膜的慢性炎症,并伴随着症状如腹泻、腹痛、腹胀、贫血等。IBD的发病原因复杂,涉及遗传、环境和免疫系统等多个因素。
数据来源
本研究纳入的患者年龄都在18岁以上,共收集了420名IBD患者的711例肠道活检,详细的表型信息和分子图谱由UMCG医学中心提供。从https://ibdmdb.org获取RNA-seq和16S测序原始数据。
研究思路
研究者们收集了335名IBD患者和16名非IBD对照组的697份新鲜冷冻肠道活检样本,对于这些样本采用总RNA测序和16S rRNA基因测序技术进行粘膜转录组和微生物特征的鉴定。结合两个数据集并将数据集与广泛的临床特征相结合,对粘膜宿主与微生物之间的相互作用进行全面研究。按照这种方法,不仅是研究粘膜基因表达或微生物群与IBD临床表型的关联,还要研究宿主与微生物之间的相互作用,同时解开疾病、部位和炎症特异性的关联,最后,在一个独立且公开的队列数据重复了主要结果。
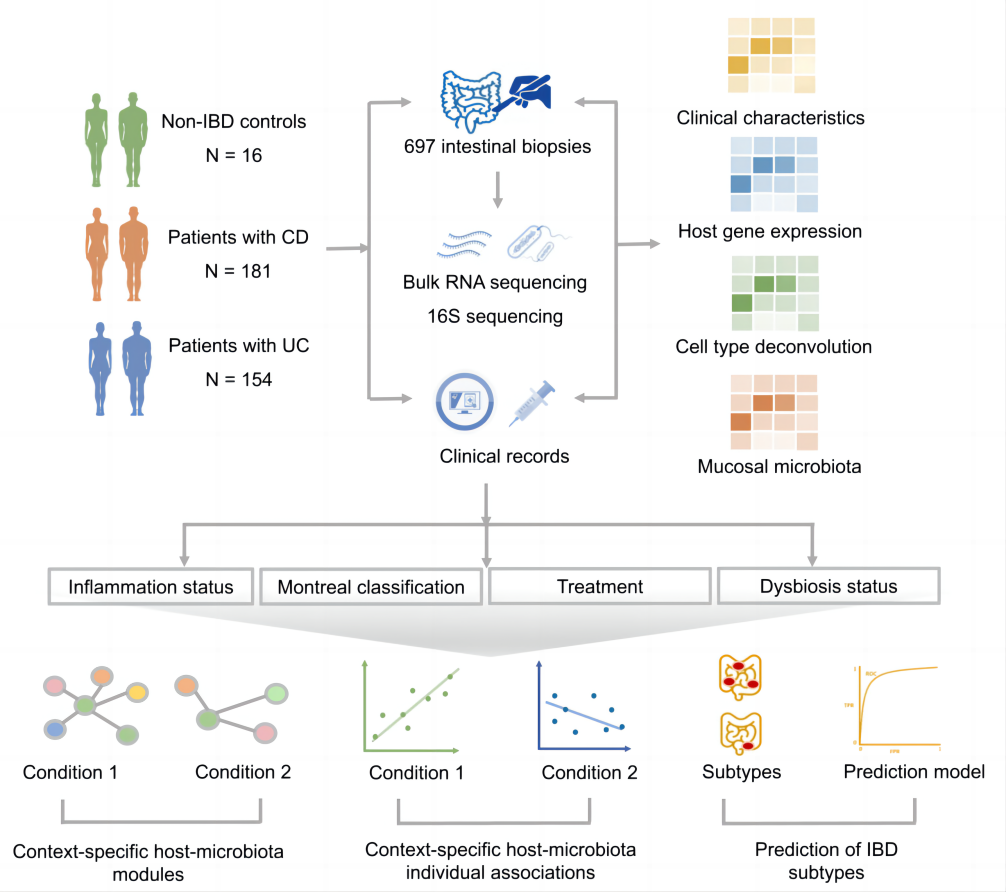
图1 研究的方法流程
主要结果
1.队列描述
697份活检样本来自结肠(64.8%)和回肠(35.2%),CD和UC患者的炎症和非炎症的活检样本占比相近。在对照组中男性和吸烟者的占比较高(P < 0.01)。除了某些类型的药物在CD或UC患者中更常用外,其他患者特征在各组中均匀分布,没有明显差异。
2.粘膜基因表达反映组织特异性、炎症状态和疾病亚型
旨在确定粘膜基因表达模式的主要决定因素和探究炎症状态下基因表达失调的情况。主成分分析显示,宿主基因表达的变异可以通过组织位置(回肠与结肠)和炎症状态(非炎症与炎症)进行解释(图2A)。差异表达基因主要富集在白细胞介素信号通路、中性粒细胞脱颗粒和细胞外基质组织等通路,富集分析显示,与UC相比,CD中Notch-1信号通路上调,而UC在维生素、辅因子和脂蛋白代谢通路上调(图2C)。因此,炎症性结肠CD和UC的潜在分子途径存在很大差异,CD和UC的炎症可能参与不同的免疫机制。
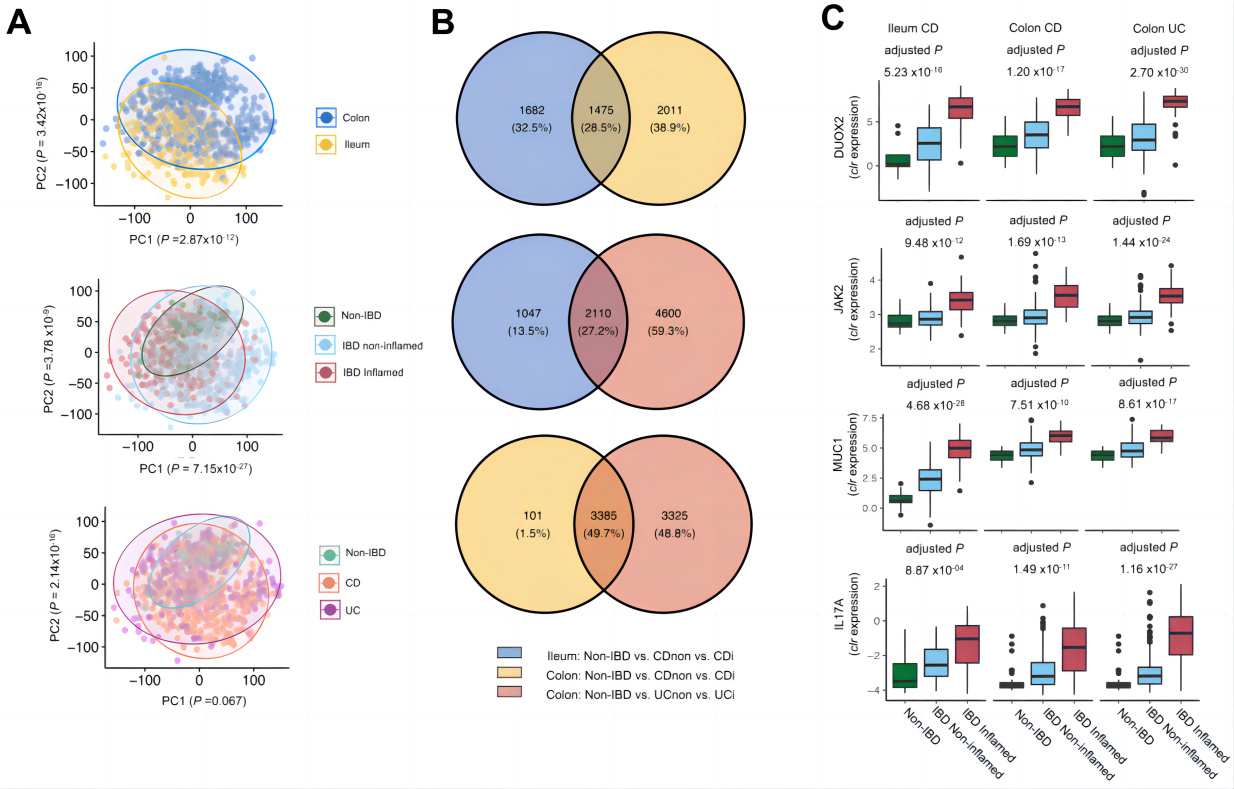
图2 IBD患者和对照组肠道组织中粘膜宿主基因的表达模式
3.粘膜微生物群组成高度个性化
分析了活检样本中的粘膜微生物群组成并通过层次关联确定与单个微生物群相关的表型因素。观察到的最常见的细菌门是拟杆菌门,其次是厚壁菌门和变形菌门。有趣的是,观察到在结肠和回肠活检样本中的差异丰富的类群很少,这可能与炎症无关(图S2)。粘膜微生物群与炎症状态、组织位置和疾病位置没有显著的影响(图3E)。采样时的年龄、CD患者与对照组、UC患者与对照组、CD患者与UC患者的比较是与粘膜微生物群组成相关的主要因素。
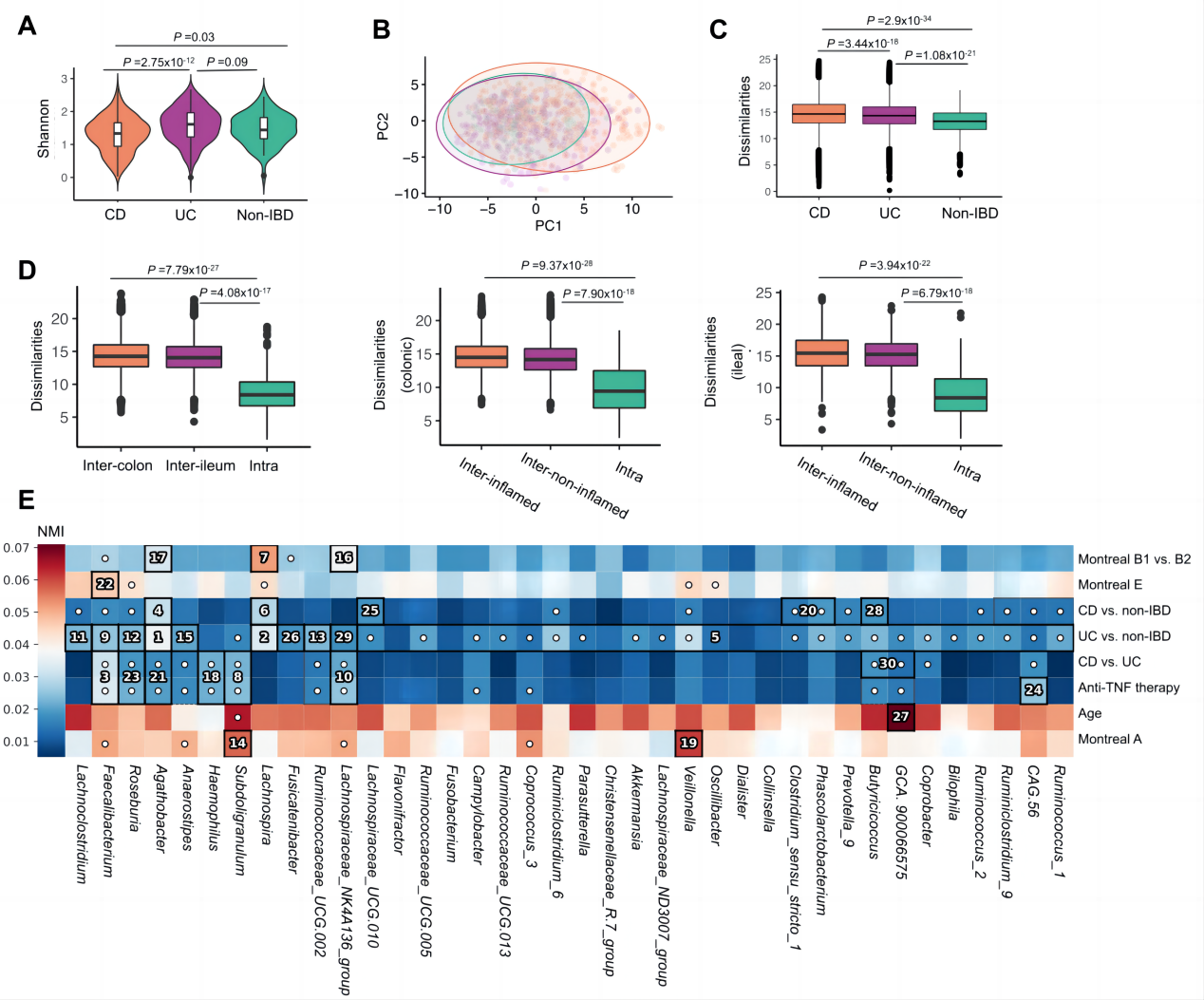
图3 IBD患者和对照组粘膜附着菌群的总体特征
4.粘膜基因表达和微生物群对IBD亚型的分类
由于在IBD亚型之间观察到基因表达和微生物的差异,利用可解释的机器学习来预测IBD表型与粘膜基因表达和微生物群之间的关联。为了避免重复测量的影响,将分析限制为从每位患者随机选取唯一样本。基本人口统计学因素(年龄、性别、BMI)与微生物群相比,基因表达在区分CD和UC方面表现出最好的预测效果,结合基因表达和粘膜微生物群时,模型表现更好。
5.确定与炎症相关的不同宿主-微生物相互作用模块
肠道DEGs是导致组织炎症的主要原因之一(图2A),为了检测这些DEGs如何与微生物群相互作用,重点研究了与组织炎症和所有131个微生物分类群相关的1,441个DEGs。对所有活检样本进行稀疏典型相关分析(sparse-CCA)并根据炎症状态分层,排除年龄、性别、BMI、批次和位置等潜在混杂因素。在炎症组织中发现了6个不同的基因模块,非炎症组织中发现了7个不同的基因模块,在炎症组织和非炎症组织中分别发现了15对和59对显著的基因-细菌对。还通过缩小采样范围的方法证实了结果的稳健性不受炎症组织和非炎症组织样本量不平衡的影响。
6.粘膜丹毒丝科细菌与胶原蛋白生物合成途径相互作用
在炎症组织和非炎症组织的重要组分中,以丹毒丝科为代表的微生物组分的权重较高,这与参与胶原生物合成、整合素细胞表面相互作用、胶原链三聚化、胶原纤维交联、胶原纤维组装、ECM蛋白多糖和ECM/胶原降解的多种ECM基因的低表达有关(图4)。
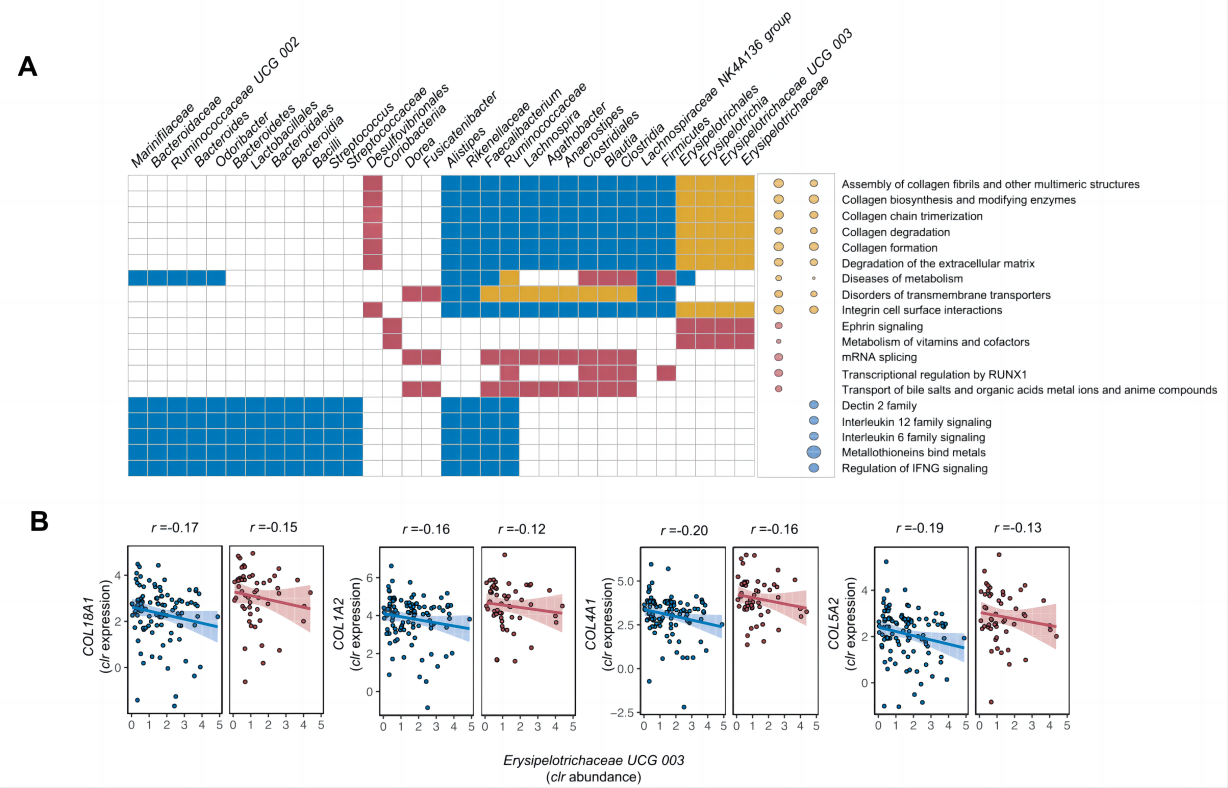
图4 IBD背景下的粘膜宿主-微生物相互作用模块
7.粘膜厌氧丁酸菌与跨膜运输正相关,与胶原蛋白生物合成负相关
由炎症组织中重要组分对5和非炎症组织中重要组分对1组成一种细菌模块。该模块与跨膜运输基因相关,主要以共生的厌氧丁酸菌类群为代表,同一细菌类群还与炎症组织中胆汁盐、有机酸的运输和mRNA剪接有关的途径相关,而与非炎症组织中胶原蛋白和ECM生物合成途径呈负相关。此外,在炎症组织中,成分对10以粘膜乳酸菌为代表,还包括链球菌科、链球菌属、韦荣球菌科和乳酸菌科,它们积极参与食物生理消化,特别是碳水化合物的发酵的。该成分的基因模块主要与水溶性维生素及其辅助因子代谢的途径相关。
8.粘膜类杆菌和产丁酸细菌类群与宿主白细胞介素信号传导和金属离子反应途径相关
在非炎症组织样本中,第二对成分主要以类杆菌和厌氧丁酸菌的特定分类群为代表。许多干扰素信号通路的表达量减少与该微生物成分的权重较高相关。此外,金属离子响应和金属硫蛋白(MT)途径与该微生物成分呈正相关。
9.纤维增生性CD患者表现出参与免疫调节的拉克氏菌相关基因网络
通过对非狭窄性、非穿透性CD患者与纤维狭窄性CD患者进行关联比较,在非狭窄性、非穿透性CD患者中观察到1405对基因-细菌对,而在纤维狭窄性CD患者中发现了620对基因-细菌对。比较不同患者组间各细菌的相关基因簇,鉴定出以粘膜梭状芽孢杆菌、粪球菌科、丹毒丝菌科和黄杆菌为代表的4个不同的网络。最大的网络是粘膜梭状芽孢杆菌基因簇,其主要参与囊泡介导的细胞转运和膜转运等细胞活化途径(图5A)。由于研究的组织不是来自纤维化区域,表明这些不同的基因-微生物群网络已经存在于非狭窄的肠道组织中。
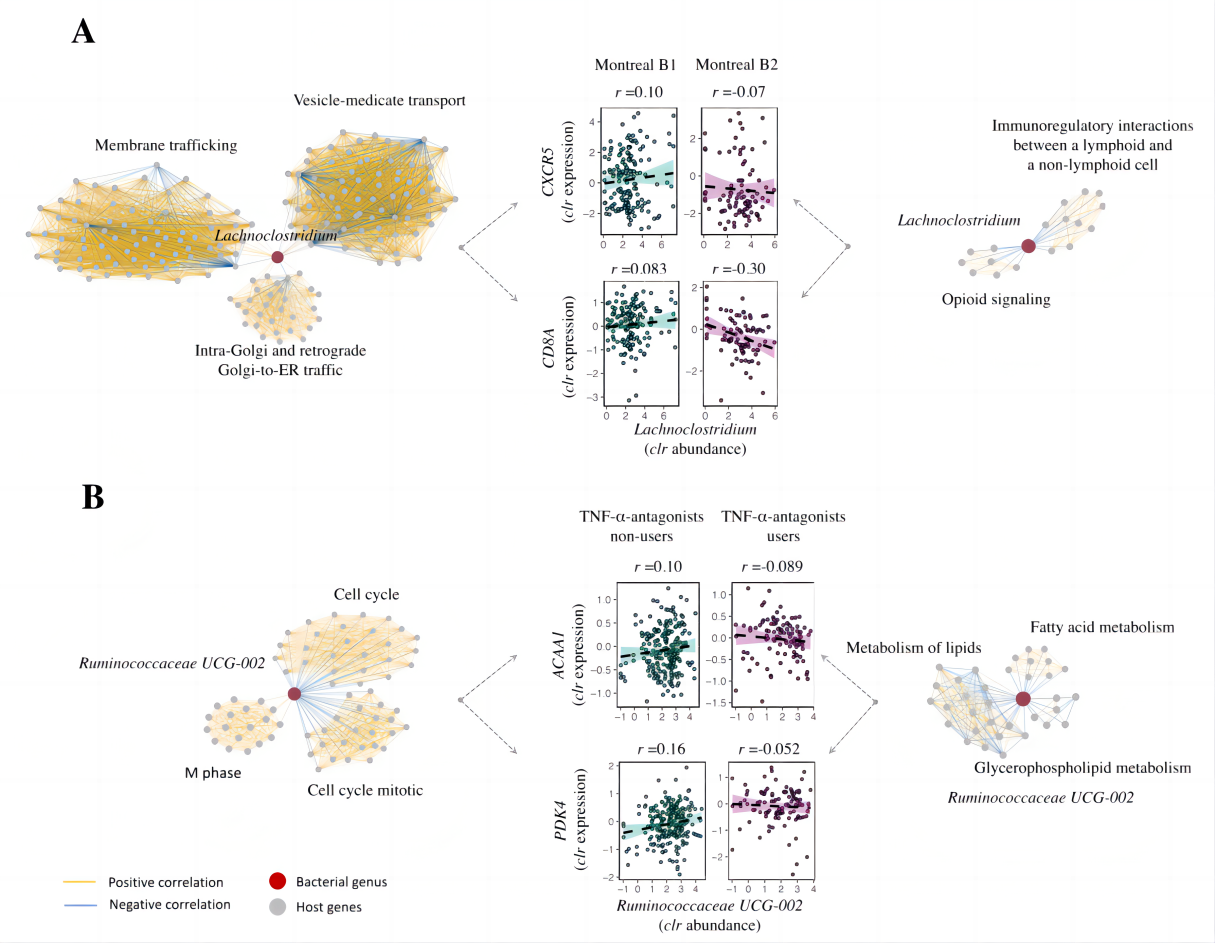
图5 纤维增生性CD和TNF-α-拮抗剂的使用显著改变了IBD背景下粘膜宿主与微生物之间的相互作用
10.TNF-α-拮抗剂的使用与与脂肪酸代谢相关的瘤胃球菌相关基因相互作用有关
比较了所有使用TNF-α-拮抗剂和未使用TNF-α-拮抗剂患者之间粘膜宿主与微生物相互作用的差异。比较显示,TNF-α-拮抗剂的使用与3个不同的细菌分类群和513个不同的基因显著相关。确定了以粘膜瘤球菌_UCG-002为代表的单个基因簇,该基因簇在使用TNF-α-拮抗剂的患者与未使用TNF-α-拮抗剂的患者中发生显著变化。粘膜瘤球菌_UCG-002在非使用者中与133个基因相关,这些基因主要富集于细胞周期相关通路,包括有丝分裂、前期中期和检查点相关基因(图5B)。TNF-α拮抗剂使用者的粘膜瘤球菌_UCG-002相关基因主要参与脂质/脂肪酸代谢、甘油磷脂生物合成和磷脂代谢。最后,研究者们减少了未使用TNF-α-拮抗剂的患者的样本数量,以匹配使用TNF-α-拮抗剂的患者的样本数量并重复了以上分析。
11.粘膜宿主与微生物的相互作用取决于个体的菌群失调情况
由于IBD患者的微生物生态失调,假设个体表达的基因与细菌相互作用的强度或方向取决于微生物群落(菌群平衡或失调)。因此,根据菌群失调评分定义了所有肠道活检样本的菌群失调(图6A、B)。通过相互作用模型,2,753个基因-细菌相互作用发生了显著变化。置换检验的进一步证实,这些相互作用并不是偶然观察到的。
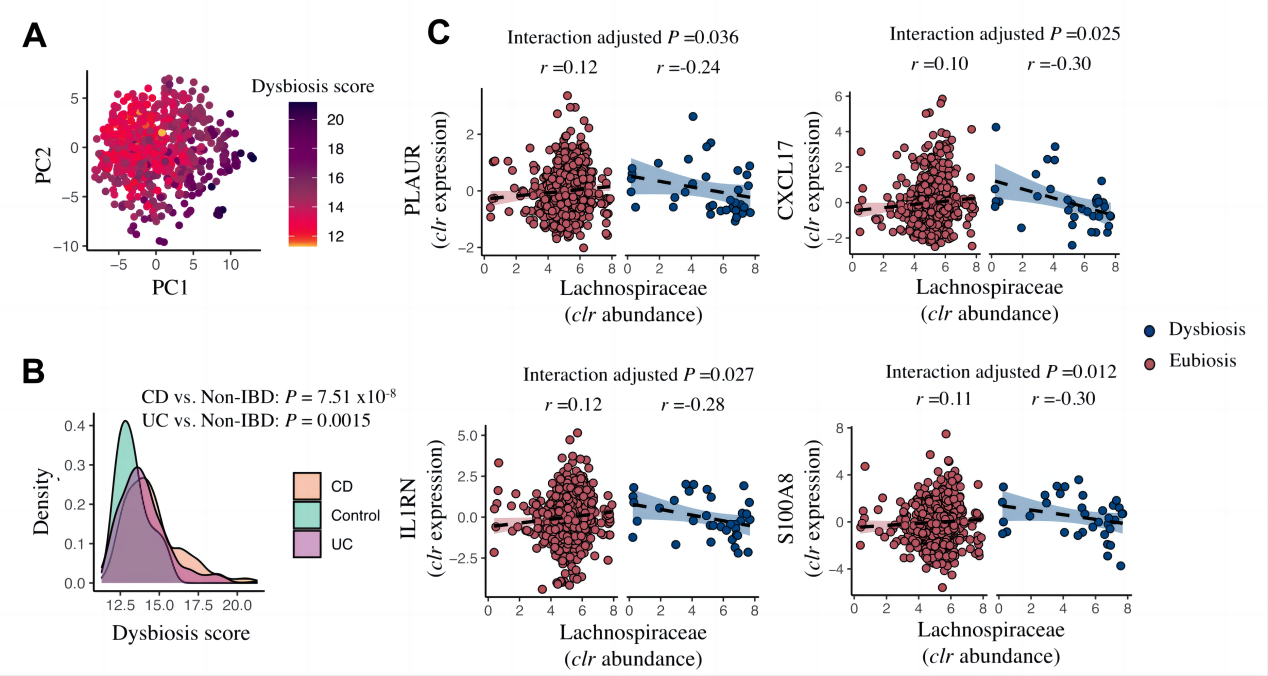
图6 粘膜宿主与微生物之间的相互作用取决于个体的菌群失调状况
12.粘膜微生物群与肠细胞类型富集的变化有关
由于肠细胞分化的改变引起肠道屏障功能障碍和免疫失调。研究者分析了粘膜微生物群和肠细胞类型之间的关系(图7)。根据宿主基因表达数据的解卷积显示,粘膜微生物丰度与特定细胞类型的富集显著相关,其中最明显的是肠上皮细胞、M1巨噬细胞、NK细胞和粘膜嗜酸性粒细胞。这些关联在可能导致肠道细胞类型富集变化的因素组合中表现得很明显,包括年龄、性别和BMI等基本因素,以及药物使用、炎症状态和组织位置(图7A)。组织炎症状态和部位对大多数肠细胞类型的影响较大。与肠上皮细胞富集显著相关的粘膜微生物群通常属于厚壁菌门(图7B)。

图7 粘膜微生物群与不同的肠粘膜细胞类型相关联
文章小结
这篇文章重点揭示了宿主与微生物的关联,炎症性肠病患者中粘膜基因表达和菌群之间的相互作用。为IBD的治疗和管理提供了新的思路,有助于更深入地理解炎症性肠病的本质,还为未来开发个性化治疗策略提供了新的思路。相信随着对这一领域的进一步研究,将能够更有效地应对炎症性肠病,改善患者的生活质量。除了采集样本外,全文基本都是生信分析,我们换个疾病、换个方向就是一篇SCI了呢,看了小云的解析,是不是已经摩拳擦掌、迫不及待了呢?套路有了,接下来就看你的了!
