
在深度学习和机器学习的助力下,医学影像分析正变得更加智能化,能够从影像中提取更多以前无法识别的信息。正是如此,深度学习和机器学习领域在医学影像分析中的应用正迅速占领研究热点的势头,特别是在肿瘤学中,成为众多研究学者炙手可热的工具!在这一过程中,每一次技术的突破和每一篇研究成果的发表,都将为科学界带来新的启示,为抗击肿瘤的战斗注入新的活力!
今天小云向大家介绍一篇IF=15.3的高质量文章!这项研究巧妙地结合了深度学习、机器学习和多模态医学影像技术,深入探讨了肾透明细胞癌(ccRCC)的术后无病生存预测问题。这篇文章设计严谨缜密、思路精妙绝伦!想要掌握这种高效研究技巧吗?那就跟随小云的步伐,一起深入探索这篇文章的亮眼之处吧~
1、本研究聚焦于当前医学研究中的热点问题——利用人工智能技术优化癌症治疗,针对肾透明细胞癌(ccRCC)的术后生存预测提出了一种创新的多模型预测方法。
2、本研究展示了深度学习和机器学习技术在医学影像分析中的高效应用,特别是在处理大规模多模态数据时的优势。通过构建单模态和多模型预测签名,研究者成功地将复杂的数据转换为直观的预测模型。 (ps:小云这里还有其他的新颖的科研热点方向,而且能提供特色数据库构建、免费思路评估、付费生信分析等服务,小伙伴们扫码call我吧~)


- 题目:基于深度学习的透明细胞肾细胞癌患者术后无病生存状态多模型预测:一项多中心队列研究
- 杂志:International Journal of Surgery
- 影响因子:IF=15.3
- 发表时间:2024年3月
研究背景
肾透明细胞癌(ccRCC)是男性中发病率最高的恶性肿瘤之一,对于复发患者来说,死亡率很高。尽管手术治疗后的临床结果中等,但一旦出现转移或复发,5年生存率会显著降低。对于晚期ccRCC患者,传统治疗如化疗和放疗效果有限,但辅助治疗(如免疫疗法或靶向疗法)可能提供一些缓解。因此,迫切需要找到能够预测ccRCC患者临床结果的指标,以指导辅助治疗的决策。尽管TNM分期系统是恶性肿瘤最常用的分类系统,但它无法全面分析组织学和放射学特征,且对于具有良好肿瘤分期的患者也可能预测出较差的临床预后。
研究思路
数据来源
- 普通队列(General cohort):包括从2008年1月至2016年12月在医院接受根治性或部分肾切除术的238名ccRCC患者。
- 癌症基因组图谱队列(TCGA cohort):招募137名ccRCC患者,且有权访问完整的组织病理学染色图像、CT图像和无病生存信息。
- 临床蛋白质组肿瘤分析联盟队列(CPTAC cohort):包括39名满足上述标准的ccRCC患者,有权访问H&E染色图像、CT图像和无病生存信息。
- 原始数据主要来自两个公共数据库:Atlas和临床蛋白质组肿瘤分析联盟
主要结果
1、单模态预测模型在预测ccRCC患者手术后无病生存状态方面表现良好
研究者开发并验证了三种单模态预测模型,这些模型基于全切片图像、细胞分割和计算机断层扫描(CT)图像,用于预测肾透明细胞癌(ccRCC)患者手术后的无病生存状态。研究者首先对414名患者的全切片图像、CT图像和临床数据进行了回顾性分析。通过深度学习和机器学习算法,分别构建了针对全切片图像的深度学习预测分数(DLPS)、基于细胞和核分割的机器学习病理组学特征(MLPS)以及基于CT图像的放射组学预测模型(RADIS)。在预测性能方面,DLPS在普通队列、TCGA队列和CPTAC队列中分别实现了0.657、0.829和0.733的AUC值(95%置信区间),显示出良好的预测能力。同样,RADIS作为非侵入性的放射组学评估,能够基于术前CT图像显著区分高生存风险的ccRCC患者,三个独立队列中的HR值分别为15.662、11.729和8.965。MLPS专注于ccRCC中的细胞和核分割,也在预测ccRCC患者五年生存状态方面表现良好,AUC值分别为0.672、0.605和0.620。
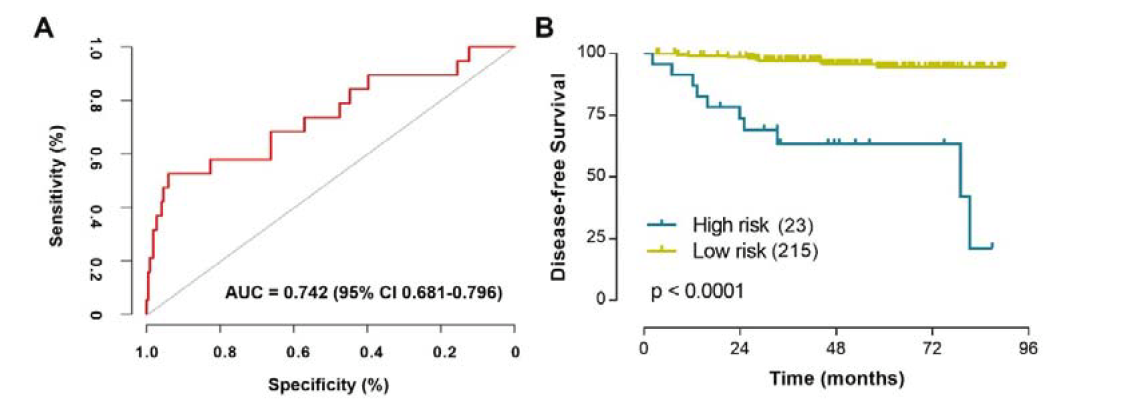
图1 模态预测模型在预测无病生存状态方面的性能
2、多模型预测签名(MMPS)在三个独立患者队列中实现了更高的AUC值,分别为0.742、0.917和0.900
通过结合三种单模态预测模型(基于全切片图像的深度学习预测分数DLPS、基于细胞和核分割的机器学习病理组学特征MLPS、以及基于CT图像的放射组学预测模型RADIS)和肿瘤的临床病理特征(肿瘤分期和分级),研究者开发了一个多模型预测签名(MMPS)。这一综合预测系统的构建过程涉及使用Cox回归分析在训练集(普通队列)中整合上述模型和特征。随后,研究者在两个独立的验证队列(TCGA队列和CPTAC队列)中对MMPS进行了验证。MMPS在预测ccRCC患者手术后无病生存状态方面展现出卓越的性能,其在三个独立患者队列中的AUC值分别达到了0.742、0.917和0.900,表明该模型具有较高的准确性和预测效能。通过设定特定的截断值,MMPS能够有效区分高风险和低风险患者群体,从而为临床治疗决策提供了更为精确的预后信息。
3、MMPS能够有效区分无病生存较差的患者,并在三个不同患者队列中显示出显著的高风险比
研究者首先利用Cox回归分析,基于深度学习预测分数(DLPS)、机器学习病理组学特征(MLPS)、放射组学预测模型(RADIS)以及肿瘤的临床病理特征(包括肿瘤分期和分级),在训练集(普通队列)中开发了MMPS。随后,研究者在两个独立的验证队列(TCGA队列和CPTAC队列)中对MMPS进行了验证,以评估其在不同患者群体中的预测效能。实验数据显示,MMPS在三个不同的患者队列中均能有效地识别出预后不良的患者,具有显著的高风险比(HR)。具体来说,在普通队列中,MMPS的HR为12.90(95%置信区间:2.443-68.120),在TCGA队列中为11.10(95%置信区间:5.467-22.520),在CPTAC队列中为8.27(95%置信区间:1.482-46.130)。这些结果表明,MMPS不仅能够准确预测患者的无病生存状态,而且其预测效能优于单模态预测模型和当前的临床预后因素,为临床实践中的患者风险评估提供了一个强有力的工具。
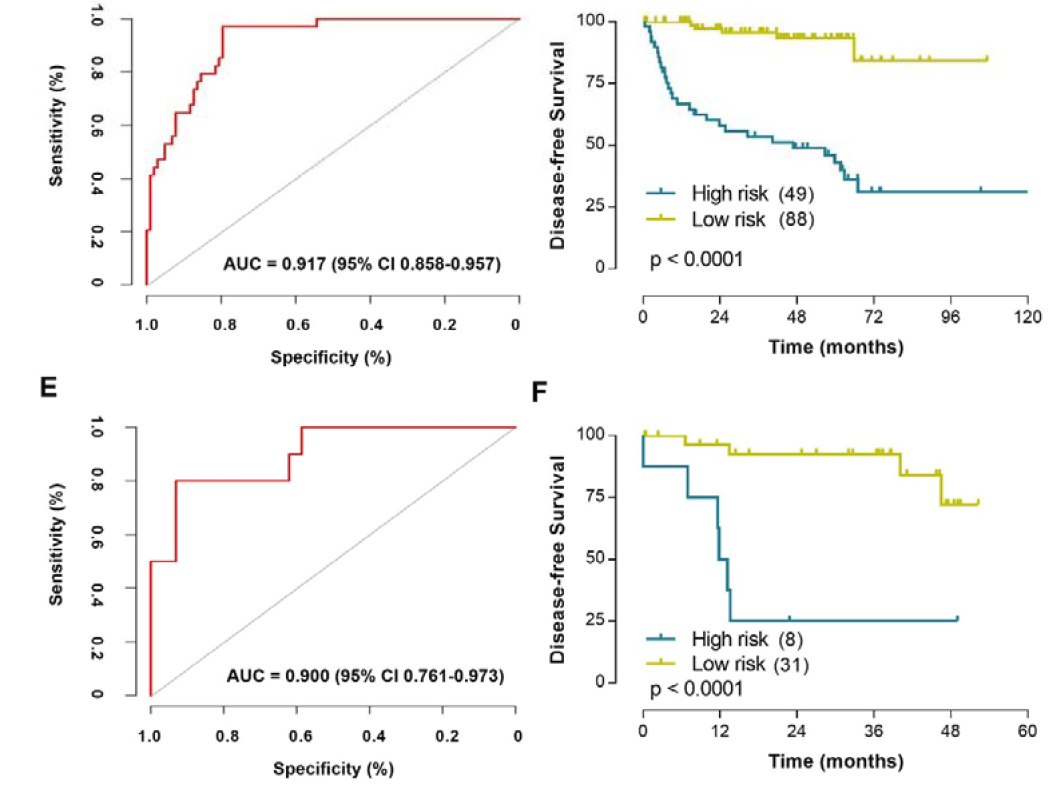
图2 MMPS在不同患者队列中区分无病生存较差患者的能力
4、MMPS在预测ccRCC患者无病生存方面的表现超过了单模态预测模型和当前临床预后因素
相较于单模态预测模型和当前的临床预后因素,多模型预测签名(MMPS)在预测肾透明细胞癌(ccRCC)患者无病生存方面表现出优越性。研究者通过整合深度学习、病理组学和放射组学数据,构建了MMPS,并在三个独立的患者队列中进行了评估。通过接收者操作特征(ROC)曲线分析,MMPS在预测无病生存状态方面展现了卓越的性能,其下曲线面积(AUC)值在不同队列中分别达到了0.742、0.917和0.900,远超过了单一模型的预测能力。此外,MMPS在多变量Cox回归分析中显示出作为独立预后因素的潜力,即使在调整了年龄、性别、肿瘤分级和分期等显著临床变量后,MMPS仍然能够显著预测患者的无病生存情况。这一结果强调了MMPS在提高ccRCC患者预后预测准确性方面的潜力,为临床决策提供了更为精确的工具。
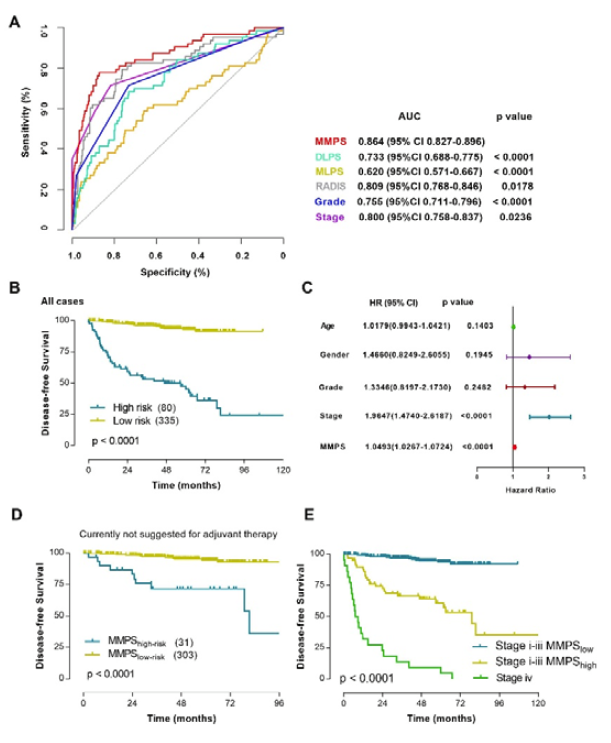
图3 MMPS与单模态预测模型和当前临床预后因素的ROC曲线下面积
5、MMPS能够为当前ccRCC辅助治疗的风险分层提供补充
研究者通过分析MMPS对不同临床分期和分级的ccRCC患者的预测能力,发现即使在当前指南不推荐接受辅助治疗的患者中,仍有部分患者根据MMPS被划分为高风险组,这表明MMPS能够识别出那些可能从辅助治疗中获益的患者。具体来说,研究者对ccRCC患者进行了基于MMPS的风险分层,发现即使在I/II期和低分级的患者中,也有9.28%的患者面临着较差的临床预后,这部分患者可能是辅助治疗的潜在候选者。此外,MMPS还能够为I-III期ccRCC患者提供更精确的风险分层,揭示了即使在这些患者中,高MMPS风险组的患者无病生存期显著缩短。
文章小结
本研究通过深度学习和机器学习技术,成功开发了一个多模型预测签名(MMPS),用于预测肾透明细胞癌(ccRCC)患者手术后的无病生存状态。研究整合了全切片图像、细胞分割、CT图像以及临床病理特征,构建了三个单模态预测模型,并进一步结合这些模型开发出MMPS。结果显示,MMPS在三个独立患者队列中均展现出高准确性和优越的预测性能,特别是在区分高风险患者方面。此外,MMPS在预测效能上超越了现有的单模态模型和临床预后因素,为ccRCC患者的个性化治疗和风险评估提供了新的工具。这一创新性成果有望成为临床实践中的实用工具,辅助医生做出更精准的治疗决策。尽管本研究在数据来源上可能受限于公共数据库的样本选择,但其巧妙融合深度学习、机器学习与多模态医学影像分析的方法,成功打造了一个高效的多模型预测系统,一举拿下IF=15+高分期刊,小伙伴们还不赶快学起来!!
如果你对深度学习和医学影像分析感兴趣,或者在投稿过程中需要专业指导,那就紧跟小云的步伐!无论需要数据分析还是寻求科研合作,小云都在这等你哦~
