
单细胞RNA测序是对特定细胞群体进行基因表达谱定量的高通量实验技术,然而细胞的空间排列常常会丢失。通过分析已知的参考图谱,将空间信息归集到scRNA-seq数据上。但是也缺乏对映射的准确性和精确性,随着发展,基于深度学习的方法提供了更多可能性!
今天带来的是复旦大学附属中山医院泌尿外科研究人员的新探索,在这项研究中,研究人员引入了一个新的发现——低级别肿瘤中上皮细胞和成纤维细胞的富集。话不多说,和小云一起来仔细学习这“超级组合”是怎么运用的吧(ps:单细胞测序文章套路的基本面没有变,但面对大家都追逐热点的竞争压力,需打好“组合拳”,不断挖掘发展新方向和细节,让思路加快灵活起来。如果还不知道怎么组合的话,快来联系小云吧~)

云服务器租赁
(加微信备注99领取试用)

发表时间:2024年2月
研究背景
透明细胞肾细胞癌是一种以代谢重编程为特征的原型肿瘤,其延伸到肿瘤细胞之外,包括肿瘤微环境中的各种细胞类型。目前关于肾细胞癌代谢重编程的研究主要集中在单独的肿瘤细胞上,或者对肿瘤微环境中的所有细胞进行混合分析,因此无法精确识别肿瘤微环境中不同细胞类型的代谢变化。
数据来源
|
数据集/队列 |
数据库 |
数据类型 |
详细信息 |
|
GSE202374 |
GEO |
RNA-Seq数据 |
76名患者的195份样本 |
|
GSE224630 |
GEO |
RNA-Seq数据 |
|
|
GSE207493 |
GEO |
RNA-Seq数据 |
|
|
GSE121638 |
GEO |
RNA-Seq数据 |
|
|
GSE159115 |
GEO |
RNA-Seq数据 |
|
|
GSE175540 |
GEO |
RNA-Seq数据 |
|
|
其他参考文献 |
见文章具体网址 |
RNA-Seq数据 |
数据思路
作者构建了一个全面、高分辨率的ccRCC单细胞图谱,以探索肿瘤微环境中的代谢重编程,还结合空间转录组学来进一步剖析空间位置的代谢异质性,观察到各种细胞类型的代谢重编程现象和相关生物学特征,包括CD8+T细胞进化中能量代谢的异质性以及巨噬细胞鞘脂代谢与M2极化之间的强相关性。作者将代谢物的空间分布分为离散型、外围型和中心型。此外,作者还开发了scMet 软件包,这是一个能够将RNA-seq 数据反卷积为scRNA-seq数据的 Python程序,旨在促进单细胞测序的临床应用。选取空间转录组学资料进行空间定位代谢活性分析。
研究结果
1.透明细胞肾细胞癌的肿瘤微环境异质性分析揭示了不同的细胞浸润模式
作者整理了透明细胞肾细胞癌(ccRCC)的公开单细胞RNA测序数据,通过筛选最后保留了76名患者的195份样本,用于肿瘤微环境的高分辨率制图,包括981294个细胞的转录组学数据,用于后续分析(图1A)。利用已建立的谱系标记,作者确定了不同的细胞亚群,根据每个样本中这些细胞类型在肿瘤微环境(TME)中的比例进行了非阴性基质因子分解,将其分为六组 (图1C),结果显示CD8+ T细胞TME明显富集高级别肿瘤,而上皮细胞TME和基质细胞TME主要与低级别肿瘤相关,强调了不同级别肿瘤细胞分布的异质性。在细胞数量归一化之后,评估了不同组织学等级和采样点内每种细胞类型的富集程度(图1D)。观察到的现象共同表明,在高级别ccRCC组织中存在明显的免疫抑制环境,强调了在这种情况下肿瘤和基质细胞的稀缺性,强调了免疫反应、肿瘤微环境和ccRCC组织学级别之间复杂的相互作用。
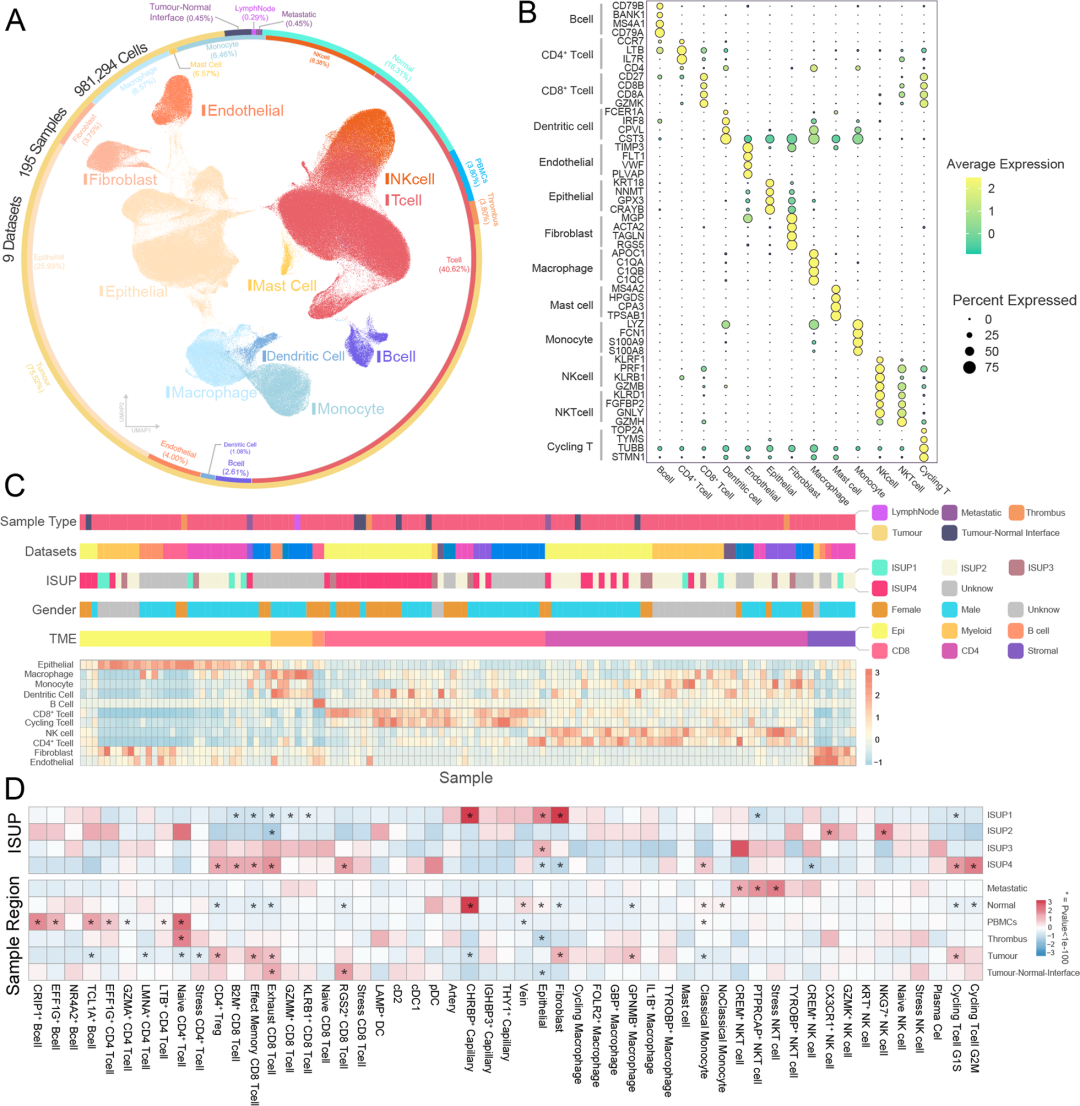
图1 透明细胞肾细胞癌的高分辨率单细胞图谱
2.揭示糖酵解的复杂性及其对肿瘤发生的多种生物学影响
作者对肿瘤细胞和正常细胞之间的代谢途径活性进行差异分析(图2A),结果显示,肿瘤细胞内许多代谢途径的功能普遍衰减,这种代谢重编程强调了发生在肿瘤细胞能量代谢中的动态适应,并进一步强调了肿瘤生物能量学的多面性。在糖酵解途径中,HK2、PFKP和PKM等基因表达升高,从而成为抑制肿瘤细胞糖酵解活性的潜在靶点(图2B);作者发现了DNA修复过程与肿瘤细胞糖酵解活性之间的相关性,还阐明了DNA复制活性、细胞增殖活性和嘌呤代谢与糖酵解活性之间的正相关(图2C);这些发现表明糖酵解活性的升高可能潜在地促进细胞增殖。通过启动肿瘤细胞的样本内聚类,获得代表这些细胞不同状态的平均表达谱。随后,对所有肿瘤样本采用非负矩阵分解,有效地将肿瘤细胞分为五种不同的状态,每种状态分类命名为:RNA剪接、缺氧、EMT、OXP和应激(图2D)。
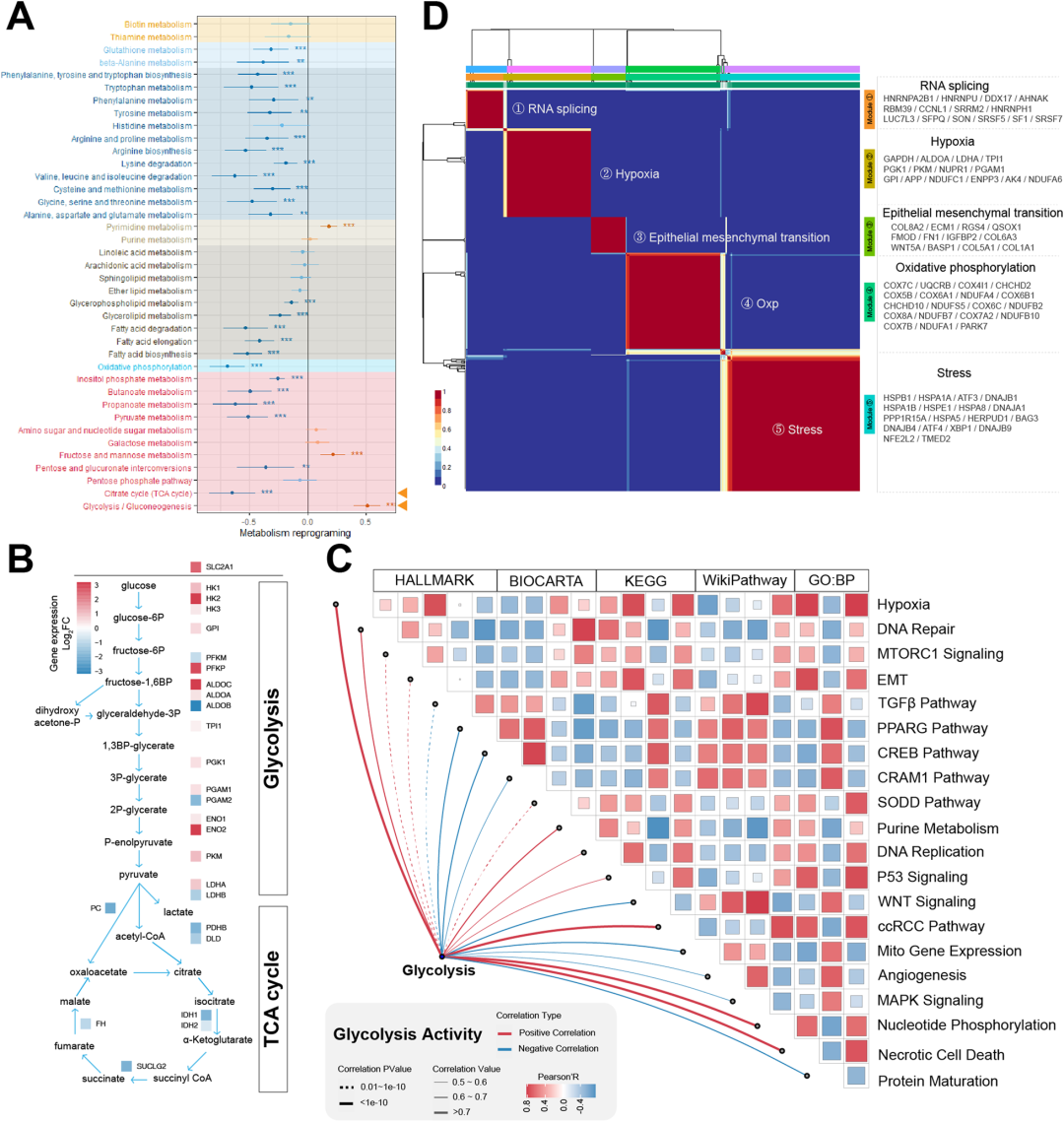
图2 透明细胞肾细胞癌肿瘤细胞的糖酵解活性明显增强
3.代谢动力学和糖酵解在CD8+ T细胞免疫应答中相互作用
作者分离了T细胞和NK细胞,用于随后的UMAP聚类分析,使用完善的谱系标记,进一步将T细胞分为不同的亚型 (图3A)。通过对T细胞和NK细胞内代谢途径活性的差异分析,以正常组织和肿瘤组织为标准分组,发现CD4+ T细胞和CD8+ T细胞是经历最明显的代谢重编程的细胞亚群(图3B)。继续研究了T细胞糖酵解活性与特定生物行为之间的关系(图3C),揭示了糖酵解与几个BIOCARTA基因组之间的负相关。根据CD8+ T细胞独特的表达基因对它们进行了分类(图3D),使用Monocle3进行伪时间分析,初始CD8+ T细胞被指定为细胞进化轨迹的起点(图3E)。原始状态的标记在伪时间的进化过程中逐渐减少(图3G),这一观察结果表明,从初始状态到细胞因子富集阶段再到耗尽状态是一个很好的发展轨迹。能量代谢相关途径表现出最初的激增,随后下降,然后是活性的二次增加(图3H);氨基酸代谢表现出明显的趋势,精氨酸代谢逐渐减少,而氨酸代谢逐渐增加(图3I),谷胱甘肽和精氨酸代谢逐渐增加(图3I);对CD8+ T细胞进行了转录因子分析,旨在揭示控制其分化和衰竭过程的主要调节因子(图3 j)。该分析的结果揭示了转录因子在不同细胞亚群中的可识别活性。
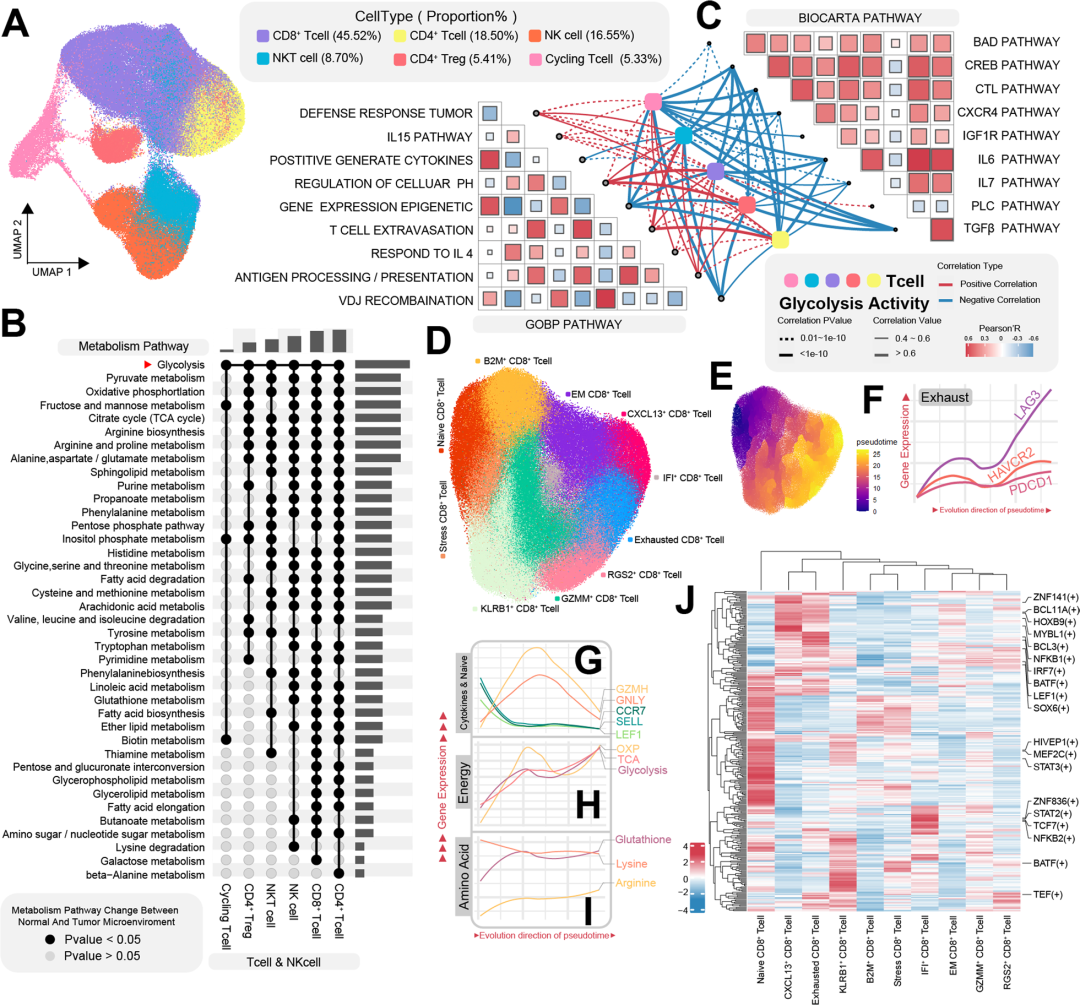
图3 肿瘤微环境中T细胞的代谢异质性和动力学
4.代谢异质性影响巨噬细胞在肿瘤微环境中的功能
作者分离巨噬细胞进行UMAP聚类,并根据高表达基因对聚类进行命名(图4A),为了探究巨噬细胞中不同代谢状态的功能意义,启动了一个基于代谢相关基因的重新聚类过程,这种分析产生了7个不同的亚类 (图4B-C)。通过分析不同代谢状态巨噬细胞在不同极化状态、ISUP组织学分级和肿瘤分级中的富集水平(图4D),发现GLY+巨噬细胞主要在M2极化巨噬细胞内富集,而AA+巨噬细胞、FATTY+巨噬细胞和PURINE+巨噬细胞在M1极化巨噬细胞内富集。在ISUP组织学分级和肿瘤分期的背景下,FAT+巨噬细胞主要存在于低级别肿瘤中,而AA+巨噬细胞在高级别肿瘤中表现出富集。
为了模拟巨噬细胞代谢进化的动态过程,基于代谢基因的表达谱进行了轨迹模拟,研究揭示了巨噬细胞代谢状态的独特蜕变,用于命名细胞团的代谢途径活性的动态变化与伪时间轨迹中相应的细胞团富集一致(图4D- G)。相关特性在OXP+巨噬细胞最丰富的时候达到峰值,表明OXP+巨噬细胞与这些细胞功能的调节之间存在潜在的相互作用。
在能量代谢方面,氧化磷酸化、三羧酸循环和糖酵解的活性呈递增趋势,与丙酮酸代谢的逐渐下降形成对比;精氨酸和脯氨酸的代谢没有明显的变化;谷胱甘肽代谢表现出最初的上升,随后沿着伪时间轨迹下降。分析了巨噬细胞特性与代谢途径活性之间的关系,鞘脂代谢与所有四种巨噬细胞特征均表现出显著的正相关,与M2极化的联系尤为明显。色氨酸代谢与M1极化的相关性最高,而谷胱甘肽代谢与吞噬活性的关系最为密切。还对巨噬细胞转录因子的研究强调了不同代谢状态下的独特活性(图4H -K)。
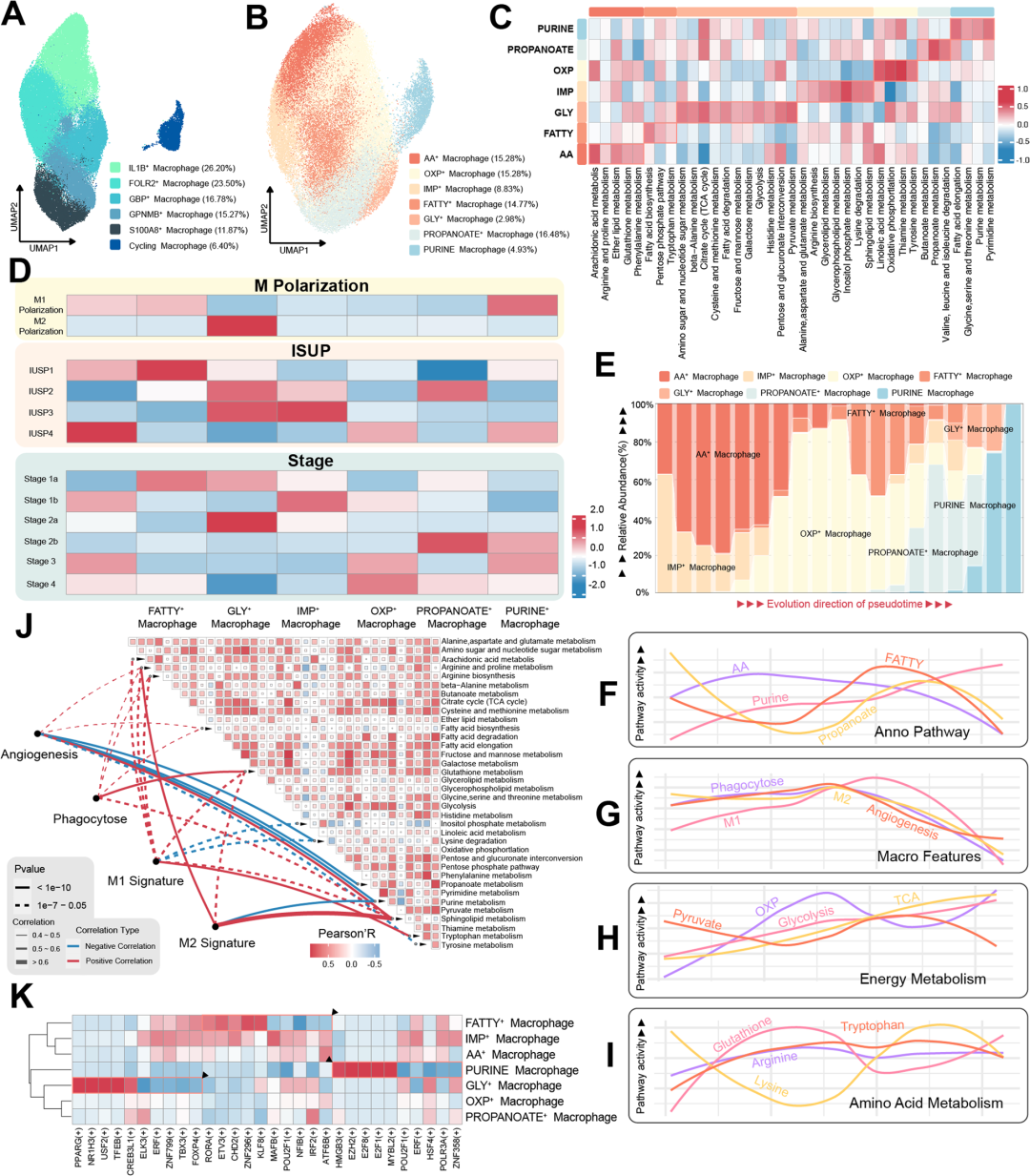
图4 巨噬细胞代谢及其高度相关的生物学意义
5. ENPP2作为潜在的预后标志物和肿瘤源性内皮细胞指标
作者分离内皮细胞并将其分为不同的亚型(图5A),在不同组织学级别中,注意到低级别肿瘤中主要富集CHRBP3+毛细血管内皮细胞(图5B)。利用CHRBP3+毛细血管内皮细胞特异性基因集的富集水平作为生存预后分析分组的基础,该分析显示,肿瘤内该基因组表达升高的患者总体生存率显著提高(图5C),暗示了CHRBP3+毛细血管内皮细胞与良好预后之间的潜在关联。作者对不同来源的内皮细胞进行了差异分析,发现动脉内皮细胞和毛细血管内皮细胞表现出惊人的相似差异(图5D),ENPP2主要在内皮细胞中表达,而不是在其他细胞类型中表达(图5E)。基于ENPP2表达的生存预后分析显示,该内皮标志物表达水平较高的患者预后较好(图5F)。因此,ENPP2可以作为肿瘤源性内皮细胞的特异性生物标志物和预后指标
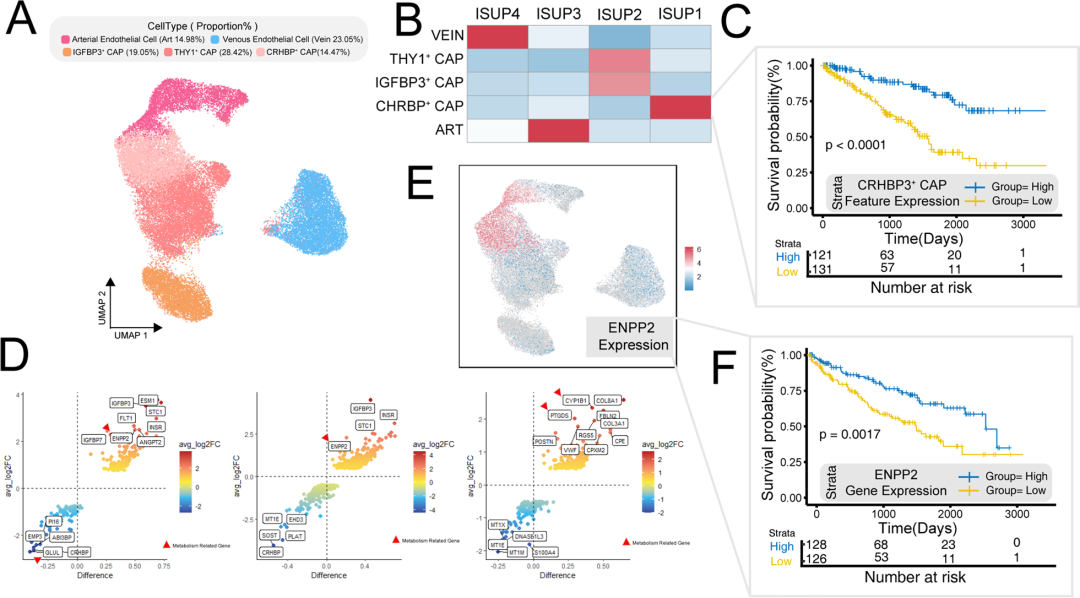
图5 巨噬内皮细胞表达异质性
6.绘制ccRCC微环境中的空间代谢活性图谱
作者利用了两个具有近圆形肿瘤病理区域的空间转录组数据集,取肿瘤中心点作为模拟肿瘤核心。使用MCP-counter,计算了各种细胞类型在组织切片上的估计分布,根据肿瘤与中心点的距离,将包膜内肿瘤的空间分布分割为多个区域,并对这些区域进行适当标记。在这两个选定的数据集中,观察到代谢过程的活性与肿瘤中心的距离呈一致的负相关(图6A-D)。表明肿瘤中心普遍存在较高的代谢状态,而能量代谢活动在肿瘤包膜附近减弱。随着离肿瘤中心距离的增加,与血管生成相关的特征呈现上升趋势(图6E)。
AMP、CDP和脂肪酸在肿瘤区域表现出明显的富集倾向,呈“中心”分布模式,相反乙酰辅酶a、鸟氨酸和酪氨酸在肿瘤包膜的近周表现出高度富集的倾向,表现出独特的“周围”分布。尽管琥珀酸盐、谷氨酸盐和富马酸盐在肿瘤区域富集,但它们的分布并没有呈现连续的轨迹,而是采用了可识别的“离散”分布(图6F-H)。
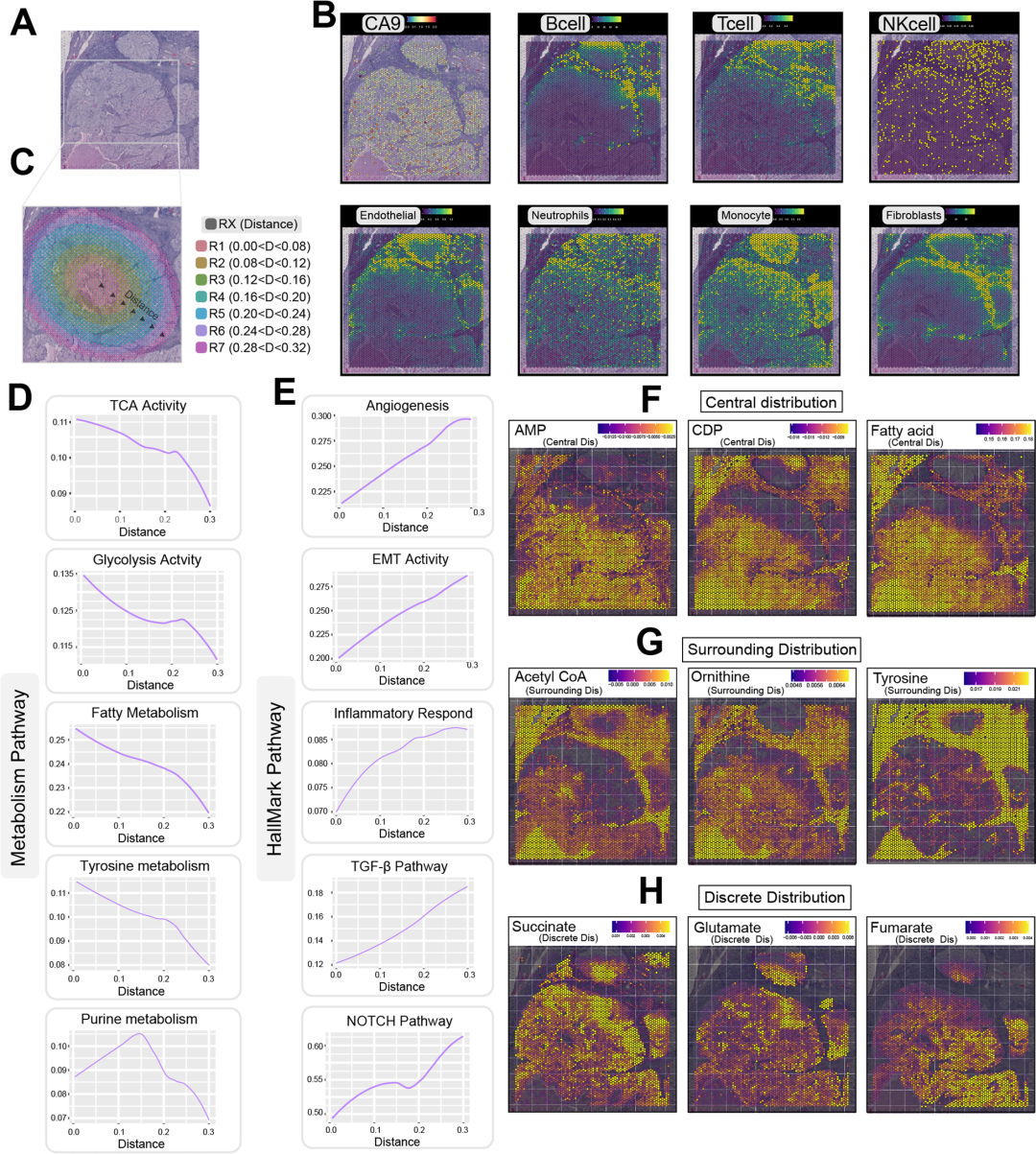
图6空间代谢活动的异质性
7. scMet:一种基于深度学习的方法,用于加速scRNA-seq在癌症中的临床应用
作者引入了scMet,这是一种利用深度学习平台(条件变分自编码器)的创新解决方案,其主要目标是将大量RNA测序数据转化为scRNA -seq谱(图7A),这一努力旨在通过减轻这些挑战来简化scRNA-seq的临床应用。利用scMet将TCGA的RNAseq数据转化为包含5401964个细胞和3000个代谢相关基因的scRNA-seq数据矩阵,得到超过150亿个RNA表达值(图7B)。拟合后,生成的UMAP图表明,scRNA-seq数据可以替代下游分析中的RNA-seq数据,显示出强大的细胞聚类性能。
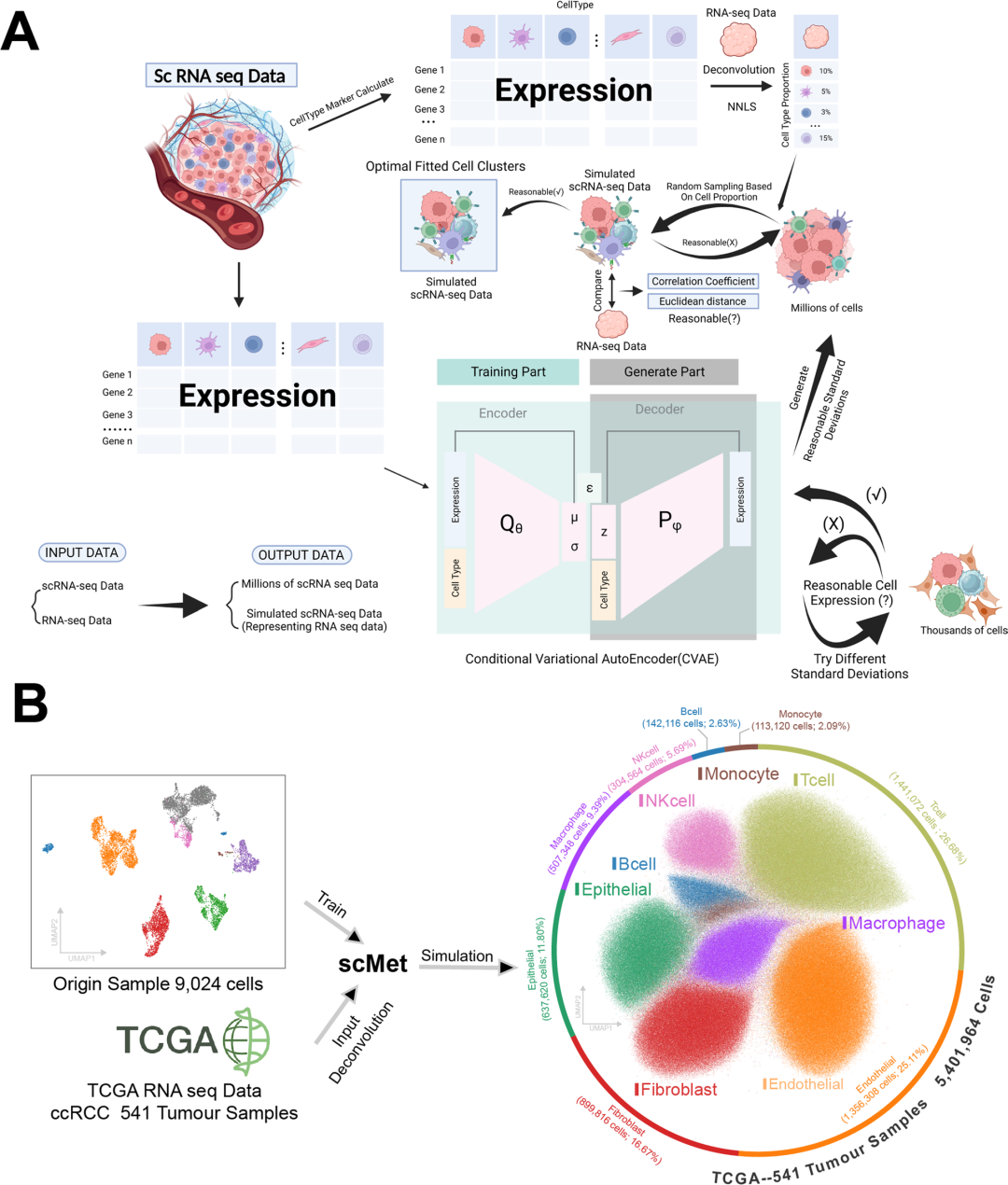
图7 scMet工作流程和TCGA RNA-seq数据的转换。
文章小结
能读到这里的小伙伴们太棒啦!本研究有很强的技术性,首先大家都知道单细胞测序是分析单个细胞基因表达谱的有力工具,有助于研究肿瘤微环境中的代谢异质性。但是,它缺乏保留空间位置信息的能力,空间转录组学的出现解决了这一局限性。而scRNA-seq的临床整合存在着巨大的障碍,包括昂贵的费用和严格的样本条件,针对此困境,作者开发scMet程序,scMet具有将RNA测序数据转换为具有高度相关性的scRNA测序数据的显著能力。
大家或许了解单细胞测序技术,单细胞多组学、空间转录组学分别是各著名期刊在2019年和2020年的年度技术,不论过去还是未来,它们对于生命科学能够带来很多新的助推作用。深度学习+单细胞RNA测序+空间转录组,技术与挑战并存,但研究越深入,paper越高分,想学习大佬们进行类似研究的,可以来找小云哦,带你走在热点前沿,学会整套组合技能!有需求直接联系啦~

定制生信分析
云服务器租赁
热点推荐
代码合集(点击查看)
原文始发于微信公众号(云生信学生物信息学):复旦大学附属医院团队出奇招——单细胞RNA测序+空间转录组+深度学习,分分钟搞定7分+文章,拼手速的时候到了!