今天要给小伙伴们带来点不一样的知识!泛癌研究是一种综合性的科研方法,涉及对多种类型癌症的共同特征和差异性进行系统性分析。我们都知道,巨噬细胞在肿瘤微环境中扮演着重要的作用,而泛癌研究则可通过多组学数据整合和单细胞分析等技术,揭示巨噬细胞在不同癌症中的多样性和复杂性。这种创新性的结合成为近年来科学家们探究肿瘤微环境的重要出发点,高分文章层出不穷!
今天要向大家分享这篇发表在《Advanced Science》(IF-15.1)的文章,便利用机器学习联合单细胞RNA测序,为肿瘤免疫治疗领域提供了重要的见解,构建了能一种预测泛癌患者ICI治疗的M.Sig模型!现在跟着小云一起走近这篇高影响文章,看看它究竟有怎样的魅力吧~
1、本研究聚焦于免疫检查点抑制剂的响应预测,通过探索APOE+巨噬细胞与CD8+耗竭T细胞之间的相互作用,为理解ICI治疗反应的机制提供了新视角。
2、本研究结合单细胞RNA测序和机器学习算法,在细胞层面上解析肿瘤微环境中的复杂相互作用。通过综合分析大量数据,研究者们构建了M.Sig模型,并利用真实世界的免疫治疗数据进行了有效的验证,展示了其方法的严谨性和创新性。(ps:想让你的研究课题精准命中,论文发表如探囊取物?别急,小云来帮忙!各种生信分析一网打尽,而且还有物美价廉的机器学习课程为你助攻!)
定制生信分析
云服务器租赁
(加微信备注99领取试用)
题目:泛癌症单细胞和空间分辨图谱分析揭示 APOE+ 巨噬细胞在免疫检查点抑制剂疗法中的免疫抑制作用
杂志:Advanced Science
影响因子:IF=15.1
免疫检查点抑制剂(ICIs)已经成为多种癌症治疗策略的主流,包括肺癌、黑色素瘤和胃肠癌等。然而,尽管ICIs在治疗某些癌症方面显示出了显著的疗效,但临床应用中仍存在一些限制,如有限的响应率和一些副作用。这些限制促使研究者开发生物标志物来预测对免疫疗法的反应,并优化治疗方案以克服免疫抵抗。传统的生物标志物研究主要关注肿瘤组织的全外显子测序(WES)或RNA测序(RNA-seq),但这些方法仅反映了肿瘤的平均遗传特征,如程序性细胞死亡配体1(PD-L1)的表达、微卫星不稳定性(MSI)和肿瘤突变负担(TMB)。最近,单细胞RNA测序(scRNA-seq)技术的发展为在细胞水平上分析基因表达提供了多种技术,有助于识别更敏感的标记物。
1、一个基于单细胞RNA测序数据和机器学习算法的M.Sig模型能够有效预测泛癌患者对免疫检查点抑制剂(ICI)治疗的反应和预后
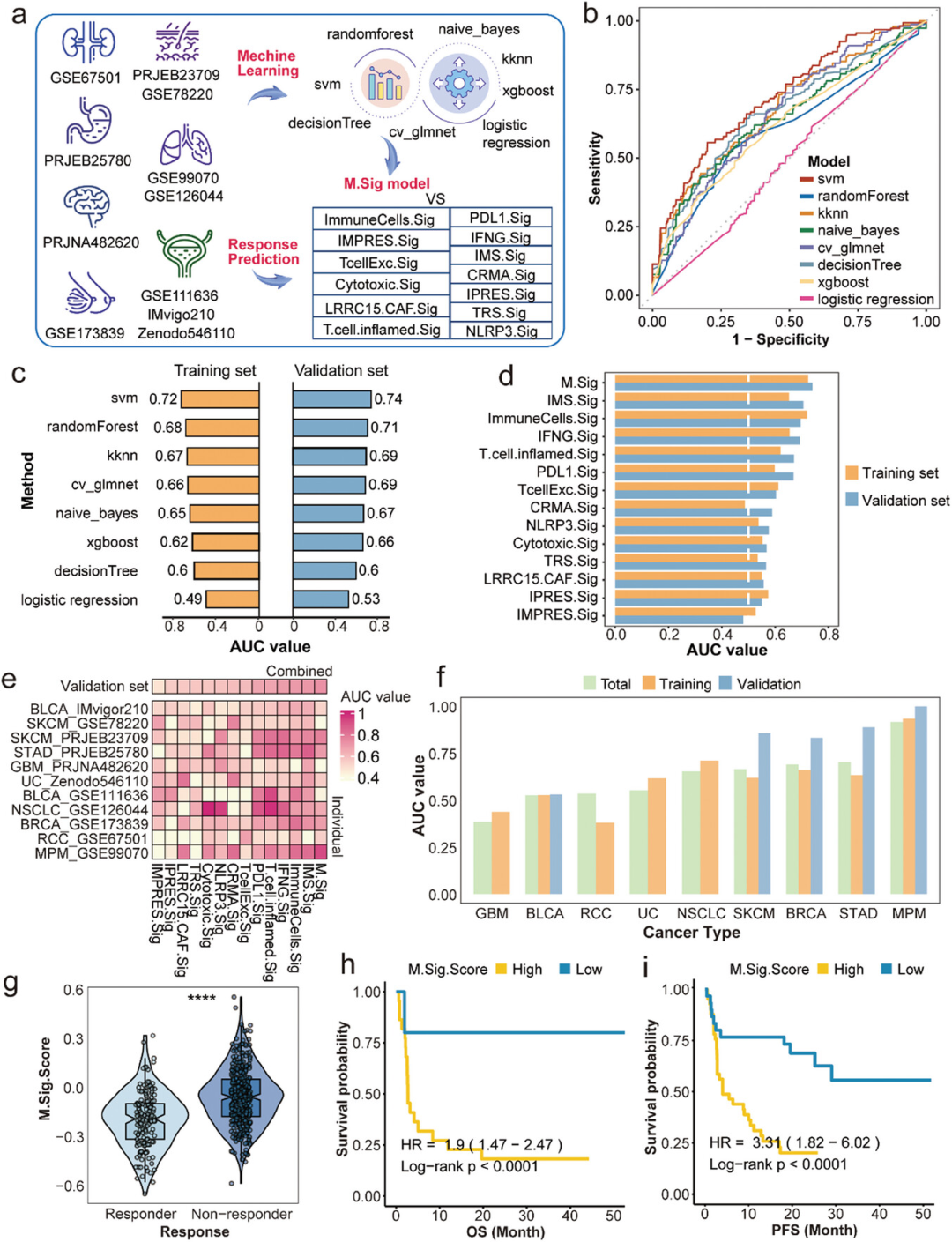
通过整合单细胞RNA测序(scRNA-seq)和批量RNA测序数据,研究者构建了一个预测免疫检查点抑制剂(ICI)治疗反应的M.Sig模型。随后,他们利用了八种机器学习算法对模型进行训练和优化,并通过交叉验证(CV)来精细化模型参数。在训练集中,支持向量机(SVM)模型展现了最高的区域下曲线(AUC)值,达到了0.72,被选为最终模型。在验证集中,该模型的AUC值保持在0.74,显示了模型的稳定性和有效性。此外,研究者还通过特征排名计算了AUC值,并定义了包含35个特征的M.Sig模型。该模型在训练集和验证集中的AUC值与之前相比变化不大,表明模型具有较好的泛化能力。通过比较M.Sig模型与其他13个已知的免疫相关签名,研究者发现M.Sig模型在训练集和验证集中的AUC值均高于其他模型,证实了M.Sig模型在预测ICI治疗反应方面的优越性。
图1 模型构建的工作流程、不同机器学习算法的AUC值比较
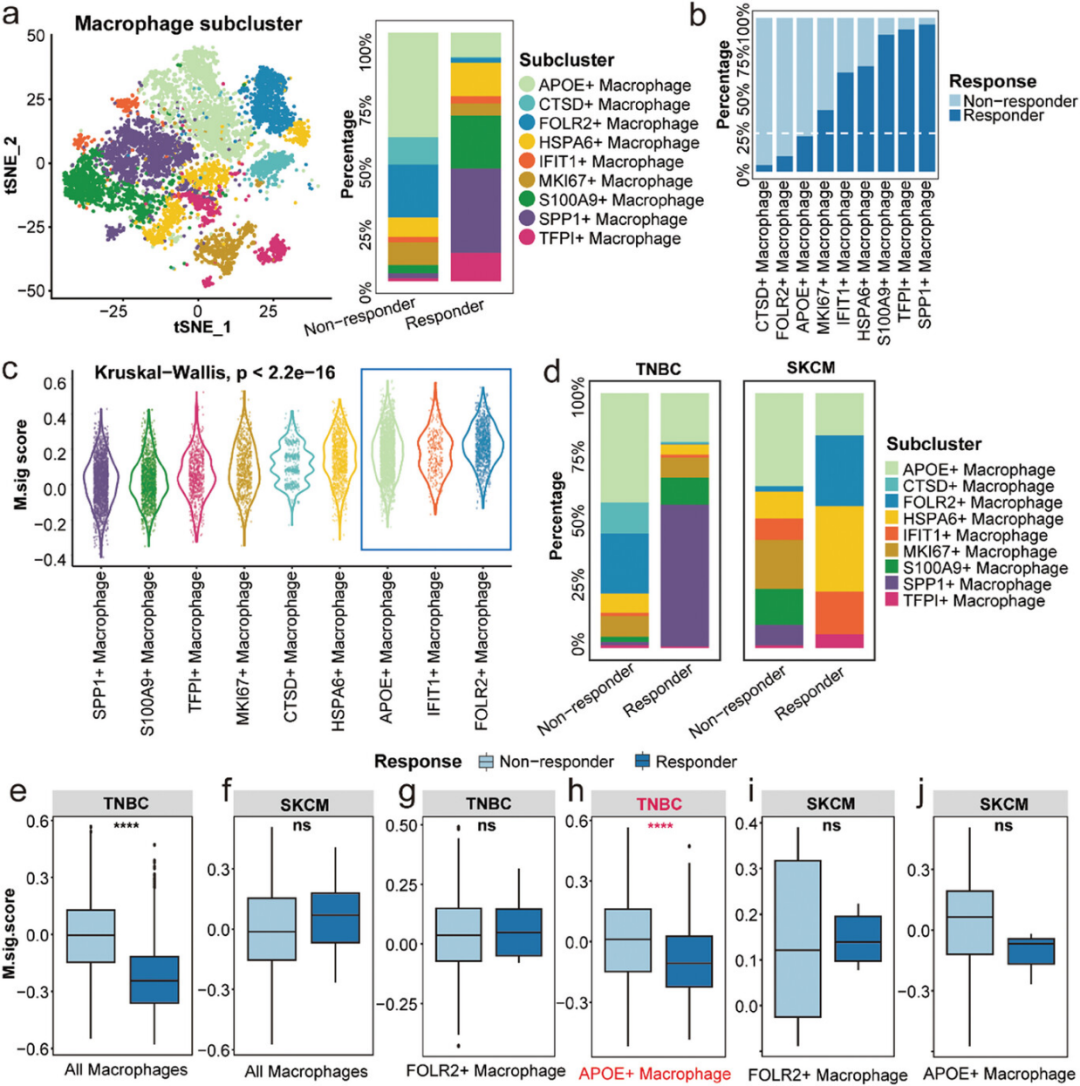
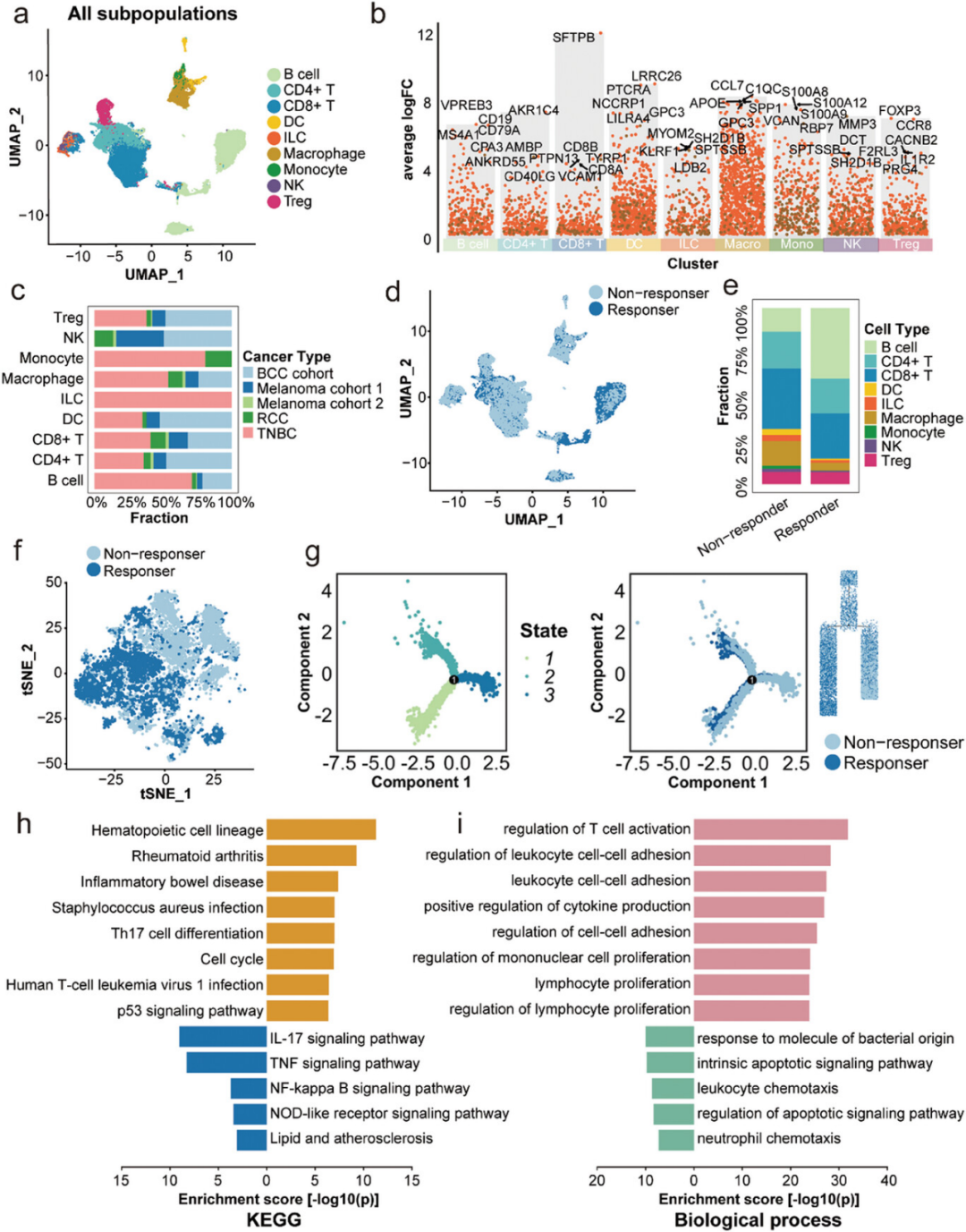
2、在三阴性乳腺癌(TNBC)中,非响应者中APOE+巨噬细胞的比例比响应者高
通过使用t-分布随机邻域嵌入(tSNE)技术对巨噬细胞进行降维处理,研究者能够将巨噬细胞细分为不同的亚群,并发现在ICI治疗的三阴性乳腺癌(TNBC)患者中,非响应者体内APOE+巨噬细胞的比例显著高于响应者。此外,通过多路免疫组化(multiplex immunohistochemistry, mIHC)分析,研究者进一步确认了APOE+巨噬细胞与CD8+耗竭T细胞(Tex)之间的相互作用,这种作用可能通过免疫抑制机制影响ICI治疗的效果。研究者还观察到,在响应者中,APOE+巨噬细胞与CD8+ Tex细胞之间的距离较非响应者更长,而在非响应者中,这些细胞之间的相互作用更为紧密。
图2 应答者和非应答者巨噬细胞亚群的 M.Sig.Score 不同
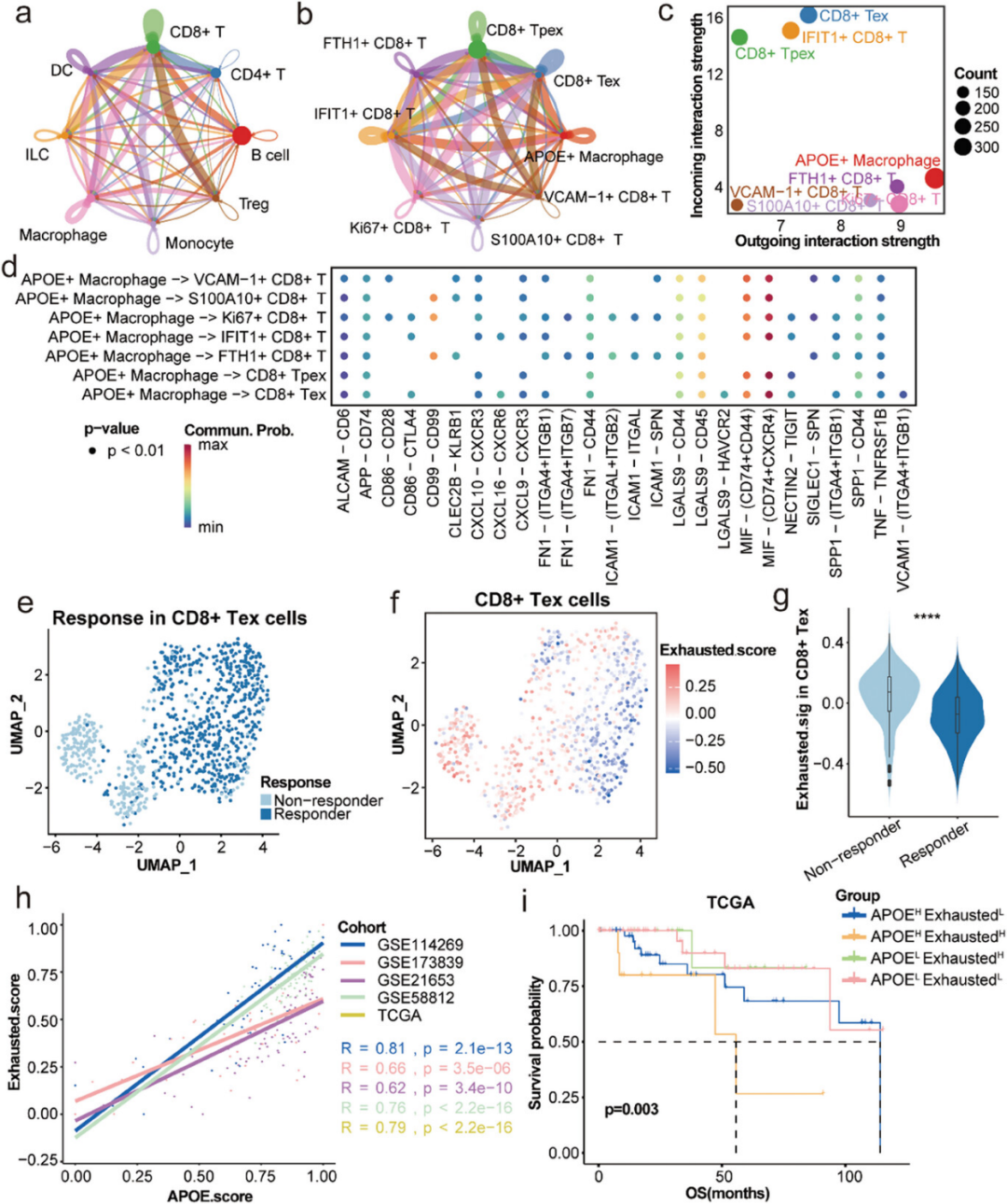
3、APOE+巨噬细胞与CD8+耗竭T(Tex)细胞之间的相互作用
通过在三阴性乳腺癌(TNBC)患者中进行细胞间通信(Cell-Cell Interaction, CCI)分析,研究者发现APOE+巨噬细胞与CD8+ T细胞之间存在大量的细胞间通信,尤其是在非响应者中,CD8+ T细胞显示出增加的入站通信强度,而APOE+巨噬细胞则显示出增加的出站通信强度。进一步的分析揭示了APOE+巨噬细胞与CD8+ Tex细胞之间的特定通信模式,其中APOE+巨噬细胞上的MIF(CD74+CXCR4)受体的通信作用尤为显著,可能通过免疫抑制作用影响ICI的疗效。此外,研究者利用来自癌症基因组图谱(TCGA)和基因表达综合数据库(GEO)的TNBC转录数据,计算了相应的Exhausted.score和APOE.score,并发现两者之间存在显著的正相关性。这些结果表明,APOE+巨噬细胞与CD8+ Tex细胞之间的相互作用可能是导致TNBC患者ICI治疗失败的关键因素之一。
图3 APOE+巨噬细胞与 CD8+ Tex 细胞之间的相互作用影响 TNBC 的 ICI 反应
4、APOE+巨噬细胞与CD8+耗竭T(Tex)细胞之间的空间距离对ICI治疗反应的影响
研究者选取了接受ICI治疗的响应者和未经治疗的患者样本,通过mIHC技术观察到在响应者中,APOE+巨噬细胞与CD8+ Tex细胞之间的距离较长,而在未经治疗的患者中,这些细胞的距离较短。通过空间分析,研究者测量了CD8+ Tex细胞和CD8+细胞毒性T细胞到APOE+巨噬细胞的最近距离,发现在响应者中大多数CD8+ Tex细胞位于APOE+巨噬细胞200微米以外,而在未经治疗的患者中,CD8+ Tex细胞数量更多且更接近APOE+巨噬细胞。相反,CD8+细胞毒性T细胞与APOE+巨噬细胞的距离在响应者中较短。
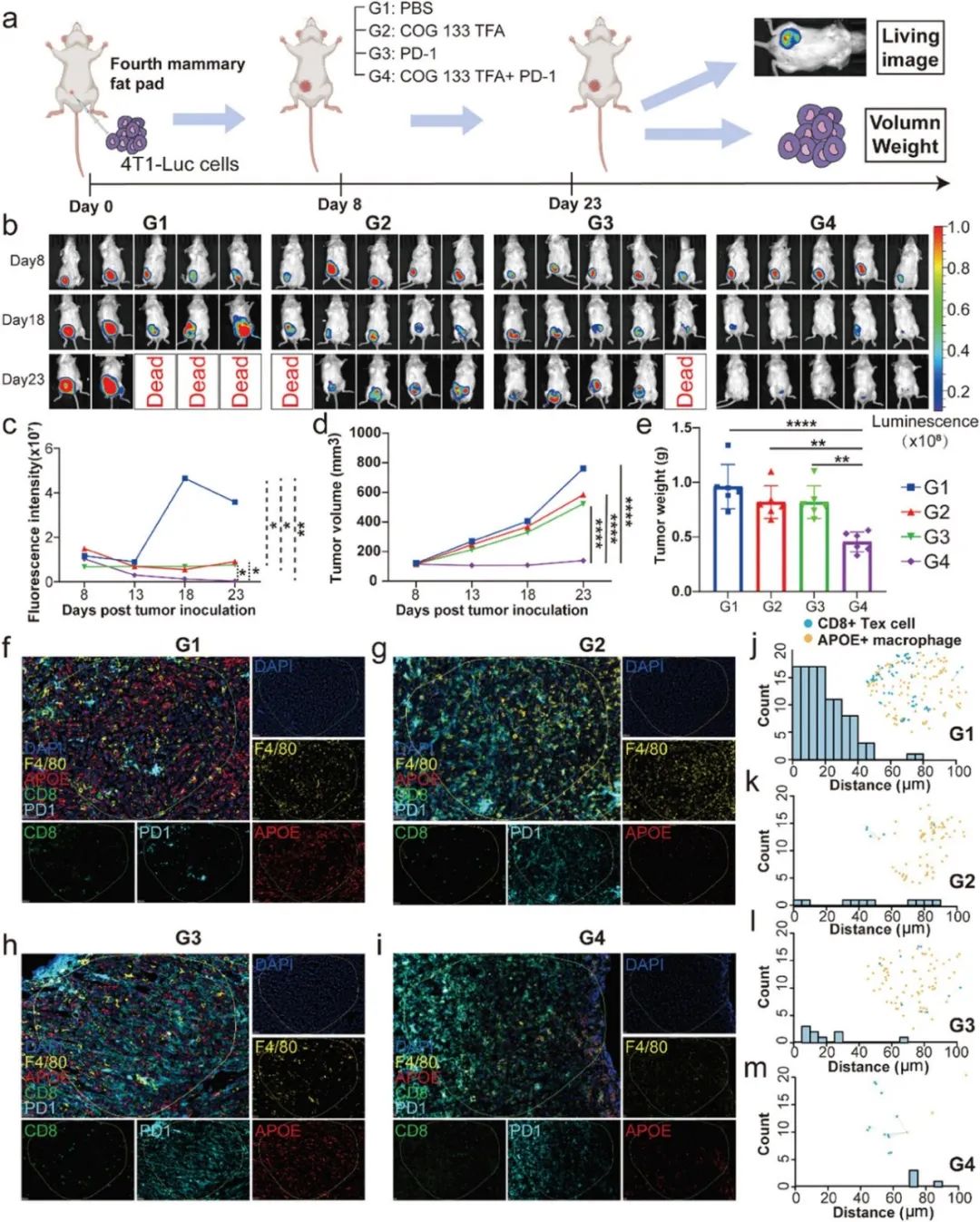
5、APOE抑制剂与ICI治疗的联合使用显示出最佳的治疗效果
通过建立4T1荷瘤小鼠模型,研究者将小鼠随机分为四组:对照组(G1)、APOE抑制剂(COG 133 TFA)治疗组(G2)、抗PD-1治疗组(G3)以及APOE抑制剂和抗PD-1联合治疗组(G4)。实验过程中,从第8天开始,通过体内成像技术观察各组小鼠肿瘤大小的变化。结果显示,联合治疗组(G4)在肿瘤抑制效果上表现最佳,与肿瘤基线相比,显示出统计学上的显著差异。此外,通过Hematoxylin-eosin(H&E)染色、ki67免疫组化(IHC)染色和多重免疫组化(mIHC)染色对小鼠肿瘤标本进行了进一步分析。H&E染色确认了肿瘤组织的存在,而ki67阳性率在联合治疗组中最低,表明该组的肿瘤增殖潜力受到抑制。mIHC染色结果表明,在联合治疗组中,APOE+巨噬细胞与CD8+ Tex细胞距离不超过100微米的细胞数量显著低于其他组,这进一步证实了APOE抑制剂能够通过干扰APOE+巨噬细胞与CD8+ Tex细胞之间的相互作用来增强ICI治疗的效果。
图4 adapalene对PCa细胞中RA信号和代谢途径的影响
在验证M.Sig模型的泛癌适用性方面,研究者采用了真实世界的免疫治疗数据进行分析。他们利用了来自不同癌症类型的数据集,通过单样本基因集富集分析(ssGSEA)算法来评估每个基因在M.Sig模型中的表达水平,并据此计算了M.Sig得分,这种方法允许研究者们评估个体患者对ICI治疗的可能反应。研究结果表明,M.Sig模型在多个癌症队列中展现出了较高的准确性,能够有效预测患者对ICI治疗的反应。
本研究通过整合单细胞RNA测序(scRNA-seq)和机器学习算法,开发了一种新的M.Sig模型,该模型能够有效预测泛癌患者对免疫检查点抑制剂(ICI)治疗的反应和预后。研究发现,在三阴性乳腺癌(TNBC)中,非响应者体内APOE+巨噬细胞的比例显著高于响应者,且APOE+巨噬细胞与CD8+耗竭T(Tex)细胞之间的相互作用及空间距离与ICI治疗反应密切相关。此外,APOE抑制剂与ICI的联合使用在小鼠模型中显示出最佳的治疗效果。这些发现揭示了APOE+巨噬细胞在肿瘤免疫微环境中的免疫抑制作用,并为提高ICI治疗效果提供了潜在的治疗策略。对机器学习感兴趣的宝子一定不要错过我们的自学课程哦~
原文始发于微信公众号(云生信学生物信息学):Advanced Science!机器学习不愧是最强辅助,巨噬细胞+单细胞测序拿捏得死死的!思路告急就看浙大赵鹏团队这篇文章!